2022年度より高等学校で新たに学び始める単元についての記事です。その背景も含めて前回の記事で,下記をまとめました。
- エンタルピーとエントロピーの必修化と指導案 >> Click here
- 電気分解と電池 >> Click here
- 水酸化鉄の表記が変更に >> Click here
- 核酸が消える >> Click here
- マグネシウムがアルカリ土類金属に >> Click here
- 原子軌道を教える
- 12族の亜鉛が遷移元素入り
- 混成軌道を教える >> Click Here
▼

前回の記事の続きです。
⑥ 原子軌道を教える
⑦ 12族の亜鉛が遷移元素入り
は,本ブログ記事で論じます。学ぶべき内容が重複しているのでちょうどよかったです。
スタバでキャラメルマキアートでも頼んで,当分補給しながら気軽に読んでいただければと思います。
YouTube動画の紹介
下記内容のYouTube動画を公開しました。
▼原子軌道とエネルギー準位
▼電子の入れ方と電子配置
改訂の根拠
以下に新学習指導要領の該当箇所を抜粋します。
カリウムの電子の入り方(原子軌道)
【該当箇所】P106 (3) 無機物質の性質 (ア) 無機物質 ㋐ 典型元素について
M殻には18個の電子が入ります。しかし,カリウムは,M殻に8電子が入りますが,9個目の電子はN殻に入ります。
これを説明するには,原子軌道を教える必要があります。殻と原子軌道の関係について論じています。
▼

亜鉛が遷移元素に
【該当箇所】P107 (3) 無機物質の性質 (ア) 無機物質 ㋑ 遷移元素について
下記に記したように,亜鉛が遷移元素に分類されていることがわかるかと思います。ただーー,亜鉛が遷移元素に分類されるのは「違和感」があります。
その点については後半に参考文献付きで論じたいと思います。途中の文章を読みたくない人は目次で飛んじゃってください。
▼

電子殻と電子配置の謎
カリウム(K)以降の元素では,M殻に8個電子が入った段階で,次の9個目の電子がN殻に入ります。
これが,どういった疑問なのかを復習しましょう。
次のYouTube動画に示すように,原子核の周りには「殻」と呼ばれる電子を収容する場所があります。
▼

化学基礎で学ぶように原子の電子核にはK殻,L殻,M殻,N殻などがあります。
殻に収容できる電子数
それぞれの電子殻に収容できる電子数は2n2個です。
n=1がK殻,n=2がL殻が割り当てられています。以下の表を参考にしてください。nの数が増えるにつれ,つぎのアルファベットになります。
2n2個を参考にすると,M殻には最大で電子を18個収容することができます。
▼
| n | 殻の名前 | 電子の収容数/ 2n2 |
| n = 1 | K殻 | 2 (= 2(1)2) |
| n = 2 | L殻 | 8 (= 2(2)2) |
| n = 3 | M殻 | 18 (= 2(3)2) |
| n = 4 | N殻 | 32 (= 2(4)2) |
エネルギー準位の低い殻から電子は収容されます。このエネルギー準位の低い殻から電子を収容した表を次に示します。電子が1個ずつ増えるに従って「水素→ヘリウム→リチウム→・・・」となります。
ヘリウム(He)でK殻の最大電子数(2)を満たしますので,さらに電子を1個もつリチウム(Li)はL殻に電子が入ります。
ネオン(Ne)でL殻の最大電子数である「8」を満たしますので,次の原子であるナトリウム(Na)ではM殻に電子が入ります。
▼
| 電子殻 | K | L | M | N | 電子殻 | K | L | M | N |
| 最大電子数 | 2 | 8 | 18 | 32 | 最大電子数 | 2 | 8 | 18 | 32 |
| 水素(H) | 1 | ナトリウム(Na) | 2 | 8 | 1 | ||||
| ヘリウム(He) | 2 | マグネシウム(Mg) | 2 | 8 | 2 | ||||
| リチウム(Li) | 2 | 1 | アルミニウム(Al) | 2 | 8 | 3 | |||
| ベリリウム(Be) | 2 | 2 | ケイ素(Si) | 2 | 8 | 4 | |||
| ホウ素(B) | 2 | 3 | リン(P) | 2 | 8 | 5 | |||
| 炭素(C) | 2 | 4 | 硫黄(S) | 2 | 8 | 6 | |||
| 窒素(N) | 2 | 5 | 塩素(Cl) | 2 | 8 | 7 | |||
| 酸素(O) | 2 | 6 | アルゴン(Ar) | 2 | 8 | 8 | |||
| フッ素(F) | 2 | 7 | カリウム(K) | 2 | 8 | 8 | 1 | ||
| ネオン(Ne) | 2 | 8 | カルシウム(Ca) | 2 | 8 | 8 | 2 |
アルゴン(Ar)ではK殻に2個,L殻に8個と殻の最大収容数を満たしたあと,M殻に8個の電子が入ります。
電子の入り方が変わる。
しかし,次のカリウム(K)でこれまで守られてきたルールが破られます。
カリウムのM殻に9個目の電子が入りません。M殻に10個の電子の収容数を残した状態で【N殻】に電子が入ります(表の赤い数字を参照)。
この現象は,カリウム(K)だけではなく,次の元素のカルシウム(Ca)でも同様に9個目と10個目のふたつの電子がN殻に入ります。
そのため,生徒から次の質問が出てきます。
M殻の最大電子収容数は「18」なのに,なぜ8個しか電子が入らないのか?
これまでの単元では「なぜこのような電子配置を取るか?」についてきちんと説明することができませんでした。(※ この疑問の説明に用いていたのが「オクテット則」です。ワルター・コッセルによって提唱されたオクテット則とは,貴ガスと同じ最外殻電子の数が8個において原子やイオンが化学的に安定に存在するという経験則です。)
「そうかぁ~。オクテット則かぁ~。18個の電子が入るのに8個が安定だから入らないのかぁ~」
とは,なりません。
電子の収容ルールは「殻(2n2)」だけでは説明できないことがわかるかと思います。
原子軌道(電子軌道)の導入
※ これから説明する「原子軌道」は「電子軌道」や「軌道」と呼ばれます。本記事では,分子軌道(混成軌道)を説明することも考慮して「原子軌道」に言葉を統一して論じたいと思います。
大学で原子軌道(s,p,d軌道)を学んだ人は,すでにお忘れかもしれませんが,高校化学を思い出してください。
周期表も「とりあえず20番目のCa」まで覚えませんでしたか?
語呂合わせも,「水兵 リーベ ぼく の 船 七曲がる シップ ス クラーク か」で20番目までです。
カルシウム(20番目)までしか語呂合わせがなかったのも,原子軌道が単元になかったためとわかります。先ほどの殻の表に「さらに」電子を入れてみると一目瞭然です。
▼
| 電子殻 | K | L | M | N | 電子殻 | K | L | M | N |
| 最大電子数 | 2 | 8 | 18 | 32 | 最大電子数 | 2 | 8 | 18 | 32 |
| ナトリウム(Na) | 2 | 8 | 1 | スカンジウム(Sc) | 2 | 8 | 9 | 2 | |
| マグネシウム(Mg) | 2 | 8 | 2 | チタン(Ti) | 2 | 8 | 10 | 2 | |
| アルミニウム(Al) | 2 | 8 | 3 | バナジウム(V) | 2 | 8 | 11 | 2 | |
| ケイ素(Si) | 2 | 8 | 4 | クロム(Cr) | 2 | 8 | 12 | 2 | |
| リン(P) | 2 | 8 | 5 | マンガン(Mn) | 2 | 8 | 13 | 2 | |
| 硫黄(S) | 2 | 8 | 6 | 鉄(Fe) | 2 | 8 | 14 | 2 | |
| 塩素(Cl) | 2 | 8 | 7 | コバルト(Co) | 2 | 8 | 15 | 2 | |
| アルゴン(Ar) | 2 | 8 | 8 | ニッケル(Ni) | 2 | 8 | 16 | 2 | |
| カリウム(K) | 2 | 8 | 8 | 1 | 銅(Cu) | 2 | 8 | 17 | 2 |
| カルシウム(Ca) | 2 | 8 | 8 | 2 | 亜鉛(Zn) | 2 | 8 | 18 | 2 |
表からもお分かりのように,カルシウムの次に電子が多い元素であるスカンジウム(Sc)では,M殻の電子が増え始めます。Scは,M殻に9個・N殻に2個の電子が入ります。
「9!? 先生ー! ナニコレ?」です。
s軌道・p軌道・d軌道・f軌道 (副殻)
K殻にはs軌道,L殻にはs軌道をp軌道,M殻にはs軌道とp軌道とd軌道と殻が大きくなるにつれて,軌道が増えます。※方位量子数は単元に入らないので,こういうものだと説明せざる負えません。
また,s軌道は1種類,p軌道は3種類,d軌道は5種類,f軌道は7種類と,それぞれの軌道の数が軌道の種類ごとに増えるのがわかるかと思います。※磁気量子数も単元に入らないでしょうね。
s軌道・p軌道・d軌道のそれぞれの形は下記の画像(動画#2 04:56)です。s軌道やp軌道の形は様々です。この形は,原子核周りの「電子の動き」を時間をかけて撮影したものと考えてください。
s軌道は単純な球形の動きですが,p軌道はダンベルのような動きをします。d軌道では,さらに複雑な動きをします。f軌道はコチラに示すように,さらに複雑な動きをすることがわかります。
▼
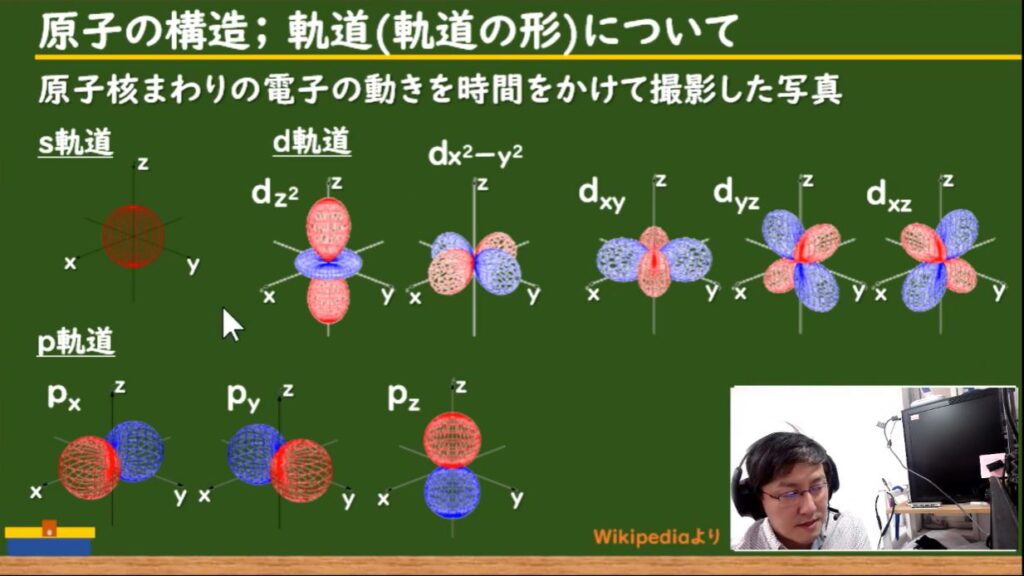
これらの「殻」と「軌道の種類」と「軌道の数」を表にします。
▼
| 殻 | s | p | p | p | d | d | d | d | d | f(7種類) | |
| n = 1 | K | 1s | |||||||||
| n = 2 | L | 2s | 2px | 2py | 2pz | ||||||
| n = 3 | M | 3s | 3px | 3py | 3pz | 3dx2-y2 | 3dz2 | 3dxy | 3dyz | 3dzx | |
| n = 4 | N | 4s | 4px | 4py | 4pz | 4dx2-y2 | 4dz2 | 4dxy | 4dyz | 4dzx | f(7種類) |
3規則:軌道への電子の入り方
各軌道への電子の入り方には「3つ」のルールがあります。
積み上げ原理(構成原理)
電子はなるべく低エネルギーの軌道に入る。(参考:積み上げ原理)
パウリの排他原理(排他律)
ひとつの軌道には,2個の電子まで収容できる(参考:パウリの排他原理)。p軌道は3種類あるので,各p軌道に2個ずつ電子が入ります。つまり,p軌道には全部で6個(2個×3種類)入るということです。これを,「p6」と表記します。
s軌道は1種類しかないので,「s2」である。d軌道は5種類あるので,「d10」と表記できます。
また,電子には上向きスピンと下向きスピンがあります。同じ軌道に2つの電子が入る時には,電子のスピンがお互いに逆になるように入ります。(動画#2 10:34)
▼

フントの規則
同エネルギーの軌道がある時,電子はそれぞれの軌道に1個ずつ入って不対電子になろうとします。(参考:フントの規則)
▼
例えば,3個の電子がある時,3種類のp軌道に各1個ずつ電子が入る。4個の電子がある時は,3種類のp軌道に各1個ずつ入れた後に,4個目の電子は対になるように入る。つまり,3種類のp軌道のうち,1つのp軌道は2個の電子をもち,2つのp軌道は1個の電子をもつ。
3種類のp軌道を「p6」および5種類のd軌道を「d10」として,まとめたものが下記の画像(動画#3 04:39)です。
▼

上記の画像から,縦軸は「① 殻の大きさ」で,横軸は「② 軌道の種類」です。
① 殻が大きくなるにつれて原子核から遠ざかるので,電子は不安定化すると考えることができます。② 軌道の形が複雑になるほど,電子は不安定化すると考えることができます。
電子の入る軌道の順番は?
エネルギー準位の低い原子軌道から電子は入るので,上記①と②を考慮すると下記画像の「斜めの黄色矢印」の順に電子が入っていきます。(積み上げ原理; #3 05:39)。
▼

電子の入る軌道の順番:1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d …
3規則に従って電子を入れる
カリウムのN殻に電子が入り始める疑問の解決
電子の入る軌道の順番がわかりましたので,3規則(構成原理・パウリの排他原理・フントの規則)に従って電子を1個ずつ入れていくと,以下の表が完成します。
▼
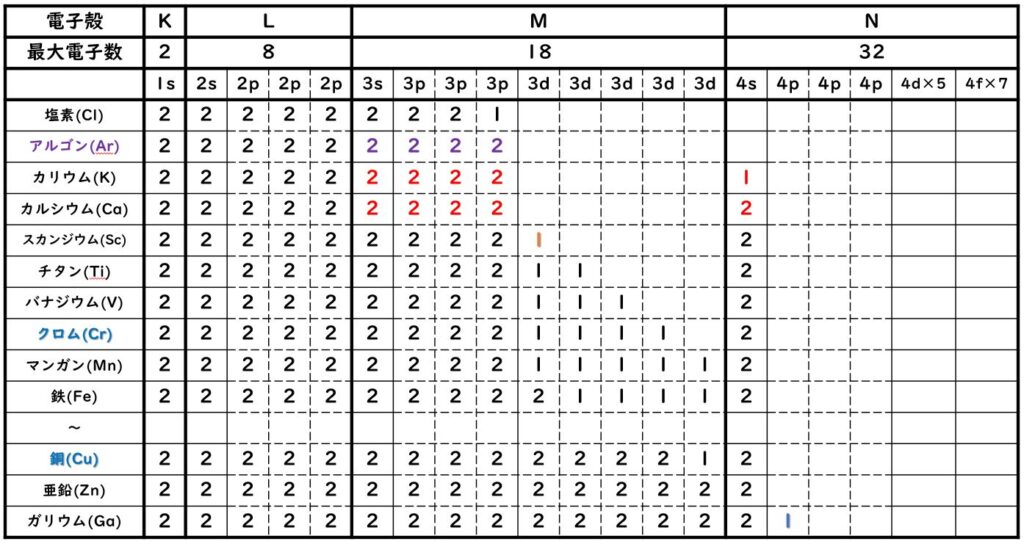
こちらの表に示したように,アルゴン(Ar)の電子配置は次のように書くことができます。
アルゴン(Ar)の電子配置:1s22s22p63s23p6
先ほど示した表と比較しながら論じたいと思います。
▼
| 電子殻 | K | L | M | N | 電子殻 | K | L | M | N |
| 最大電子数 | 2 | 8 | 18 | 32 | 最大電子数 | 2 | 8 | 18 | 32 |
| ナトリウム(Na) | 2 | 8 | 1 | スカンジウム(Sc) | 2 | 8 | 9 | 2 | |
| マグネシウム(Mg) | 2 | 8 | 2 | チタン(Ti) | 2 | 8 | 10 | 2 | |
| アルミニウム(Al) | 2 | 8 | 3 | バナジウム(V) | 2 | 8 | 11 | 2 | |
| ケイ素(Si) | 2 | 8 | 4 | クロム(Cr) | 2 | 8 | 12 | 2 | |
| リン(P) | 2 | 8 | 5 | マンガン(Mn) | 2 | 8 | 13 | 2 | |
| 硫黄(S) | 2 | 8 | 6 | 鉄(Fe) | 2 | 8 | 14 | 2 | |
| 塩素(Cl) | 2 | 8 | 7 | コバルト(Co) | 2 | 8 | 15 | 2 | |
| アルゴン(Ar) | 2 | 8 | 8 | ニッケル(Ni) | 2 | 8 | 16 | 2 | |
| カリウム(K) | 2 | 8 | 8 | 1 | 銅(Cu) | 2 | 8 | 17 | 2 |
| カルシウム(Ca) | 2 | 8 | 8 | 2 | 亜鉛(Zn) | 2 | 8 | 18 | 2 |
例えば,アルゴン(Ar)はM殻に8個の電子が収容されています。これを軌道で見てみると,3s軌道に2個と3種類の3p軌道に各2個ずつの計6個の8個(3s23p6)が収容されていることがわかります。
3p軌道に電子が収容された後,次に電子が入る低エネルギーの順位は「3d軌道」ではなく「4s軌道」でしたね。そのため,M殻の最大電子収容数18を満たす前に,N殻の4s軌道に電子が入ります。
なぜ,カリウムではM殻の最大電子数を満たす前にN殻に電子が入るのか?
Ans. 殻には軌道がある。電子の入り方に3規則があり,そのルールに従うとM殻の最大電子数を満たす前にN殻に電子が入り始める。これを軌道で答えると,M殻の3d軌道よりも,N殻の4s軌道の方がエネルギー準位が低いために,電子はN殻の4s軌道に入るため,M殻の最大電子数を満たすまえに,N殻に電子が入り始める。
さて,先に書いたようにスカンジウム(Sc)では,N殻に電子が2個入った後にM殻に電子が1個入って「9個」となりました。これについても軌道の表を見ればわかるかと思います。
スカンジウム(Sc)の4s軌道に電子が2個入った後に,次の電子が3d軌道に入っただけです。3d軌道があるM殻としては,収容電子数が「9個」となっています。お分かりになりましたか。
塩化物イオンが安定な理由
学習指導要領のカリウムの続きに「塩化物イオンでは,M殻が最大収容数の電子で満たされていなくても安定に存在できる理由に触れること」と書いてあります。
この疑問についても軌道で説明することができます。表から,塩素の電子配置は,1s22s22p63s23p5であることがわかります。塩素のp軌道に電子がひとつ入れる未充填の軌道があります。この未充填の軌道に電子が入ることで,p軌道のすべての電子が互いに対となって安定化します。
結果として,塩素が1個の電子を取り入れてイオンとなった塩化物イオンの電子配置は,1s22s22p63s23p6 で安定となります。
Ans. 塩化物イオンが安定となる理由は,3p軌道の電子がひとつ余った状態であり,これに対をなす電子が入ることで安定化する。M殻は18の電子を収容することができるが,d軌道の電子を全て埋める必要はなく,p軌道がすべて埋まった「塩化物イオン」はM殻を満たすことなく安定化する。
陽イオンのなり方 (電子の出方)
鉄原子の電子配置は,1s22s22p63s23p63d64s2です。電子の入り方は,4s軌道に先に2個の電子が入った後に,3d軌道に電子が6個入っていきます。
電子の入り方は,(・・・)~3p軌道 → 4s軌道 → 3d軌道 です。
しかし,電子の出方は外側の軌道の電子から出ていきます。鉄原子であれば,4s軌道の電子から出ていくことになります。
具体的には,
1個の電子が出たFeの1価イオンの電子配置は,1s22s22p63s23p63d64s1
2個の電子がでたFeの2価イオンの電子配置は,1s22s22p63s23p63d6
3個の電子が出たFeの3価イオンの電子配置は,1s22s22p63s23p63d5
となります。
電子の出方は,外側の軌道からでる。
この理由は,電子が入る前の軌道の安定性と電子が入った軌道の安定性に差があるからです。電子が入る前は,4s軌道の方が3d軌道に比べて安定でしたが,電子が入った後の軌道は3d軌道の方が4s軌道に比べて安定になります。
※ 入り方と同じように電子が出ていくと勘違いしている生徒さんが極々たまにいます。
特殊な電子配置 クロム(Cr)と銅(Cu)
上記の表から,クロム(Cr)と銅(Cu)の電子配置を考えると以下のように書けます。
クロム(Cr):1s22s22p63s23p63d44s2
銅(Cu):1s22s22p63s23p63d94s2
それぞれを「殻」で表すと次のようになります。(カッコ)の中は電子数です。
クロム(Cr):K(2) L(8) M(12) N(2)
銅(Cu):K(2) L(8) M(17) N(2)
実は、クロムと銅については,間違えています!!
クロム(Cr)の電子配置をみると,1個ずつ電子が入ったd軌道が4つと何も入っていないd軌道が1つあります。銅(Cu)の電子配置では,1個だけ電子が入ったd軌道があります。
量子論的効果といいますが,電子が複数存在するときに,スピンが同じ方向を向いたりするとエネルギーが安定化します。(参考文献:ヘリウム様原子におけるフントの第一規則の起源)また,塩化物イオンと同様に,ひとつだけ電子が単独で存在するより,互いに逆向きのスピンで軌道を埋めたほうが安定化することがあります。
このように電子の入り方が変化するのは,d電子が中途半端に詰まっているd4かd9です。つまり,クロム(Cr)と銅(Cu)の正しい電子配置と殻は次の通りです。
クロム(Cr):1s22s22p63s23p63d54s1
銅(Cu):1s22s22p63s23p63d104s1
このように,d軌道に5個の電子が入ることで,スピンが同じ方向を向きエネルギー的に安定化します。また,d軌道に10個の電子が入ることで,d軌道の電子が全て互いに逆向きスピンで充填され,エネルギー的に安定化します。
「殻」で書くと次のとおりです。
クロム(Cr):K(2) L(8) M(13) N(1)
銅(Cu):K(2) L(8) M(18) N(1)

このクロム(Cr)と銅(Cu)で「殻の電子数の値」が変化することも,多くの受験生を悩ませてきました。
。
最外殻の電子配置 というWord
さて,殻から始まり軌道を学びましたが,再び「殻」のお話です。最外殻の電子配置というWordがあります。これまでの高校化学でも最外殻電子という言葉は学んでいます。最外殻電子とは,最も外側にある「殻」に存在する電子のことを示します。
最外殻の電子配置を学ぶ上で,最も外側の殻が何かをわかっておく必要があります。
水素とヘリウムは【K殻】 が最外殻です。1s軌道に電子が入るので,1s軌道を持つK殻が最外殻といえます。
リチウムからネオンまでは【L殻】が最外殻です。2sと2p軌道に電子が入るので,2sと2p軌道をもつL殻が当然最外殻です。
ナトリウムからアルゴンまでは【M殻】が最外殻です。3sと3p軌道に電子が入るのでM殻ですよね。
そして,これまで論じてきたように,カリウムはN殻の4s軌道に電子を1個もつので最外殻はN殻です。カルシウムも同様に最外殻はN殻です。
では,3d軌道に電子が入るスカンジウム(Sc)の最外殻は何でしょう?
当然,3d軌道をもつM殻が最外殻ではなく,電子が2個入った4s軌道が最外殻ですよね。
最外殻のケアレスミスとしては,電子が入っている軌道を最外殻と誤認することです。冷静に考えると間違えません。
原子の最外殻の電子配置は8種類のみ
最外殻の電子配置を考えてみましょう。
水素:K殻 1s1
へリウム:K殻 1s2
リチウム:1s22s1 L殻が最外殻だから,最外殻の電子配置は 2s1 となる
ベリリウム:1s22s2
ホウ素:1s22s22p1 リチウムと同様に考えると,最外殻の電子配置は 2s22p1 となる。
以下,最外殻の電子配置だけを示す。
炭素:L殻 2s22p2
~
ネオン:L殻 2s22p6
ナトリウム:M殻 3s2
~
アルミニウム:M殻 3s23p1
~
カルシウム:N殻 4s2
そして,1s2も2s2も3s2も4s2も s軌道に電子を2個もっているのを同じとして,両方とも最外殻の電子配置は「s2」とみなすことができます。これを踏まえて,最外殻の電子配置を考えると以下の通りです。
s1, s2, s2p1, s2p2, s2p3, s2p4, s2p5, s2p6
カルシウムの次の原子であるスカンジウム(Sc)の電子配置を改めてみてみようかと思います。
スカンジウム(Sc):1s22s22p63s23p63d14s2
スカンジウムの最外殻は「4s」でしたよね。つまり,スカンジウムの最外殻電子配置は「s2」です。ここで重要な事は,スカンジウムから亜鉛までのd軌道の電子数が増えても,最外殻の電子配置にd軌道の電子は関与しません。
結果として,原子の最外殻の電子配置は先と同じ下記の8種類となります。
s1, s2, s2p1, s2p2, s2p3, s2p4, s2p5, s2p6
これが,「遷移元素の性質は各周期のアルカリ土類元素と性質と似ている」という説明につながります。具体的な元素名で言い直すと,「Sc~Znまでの遷移元素は同じ第4周期のCaと性質が似ている」ということです。
▼
ScからZnまでの最外殻はN殻であり,ScからZnまでの最外殻電子配置は「s2」なのでカルシウムの最外殻電子配置「s2」と同じだからです。
「周期表は性質が似ているものが縦方向に並んでいる」と先生から教わると思います。そして,同時に「遷移元素は同周期のアルカリ土類元素と性質が似る(横方向)」とも言われます。(どっち?)
この縦方向にも横方向にも性質が似るのを軌道の説明なしで理解するのは難しいですよね。
軌道が説明できることで変わること
さて,殻だけではなく軌道を学ぶことで,色々な疑問を説明できることがわかります。ざっくりと説明できることをまとめます。
- カリウム(K)の電子の入り方 (学習指導要領)
- 塩化物イオン(Cl–)の安定性 (学習指導要領)
- クロム(Cr)の殻における電子数
- 銅(Cu)の殻における電子数
- カルシウム(Ca)以上の原子の電子配置
- 周期表の縦方向に性質が似ているということ (最外殻の電子配置が同じ)
- 遷移元素の性質は同周期のアルカリ土類金属と性質が似る (遷移元素の原子の最外殻電子はs2)
- イオン化エネルギーがガタガタしている理由
- 電子親和力がガタガタしている理由
亜鉛が遷移元素に
2015年以降のIUPAC命名法(化合物命名法:IUPAC命名法に準拠),東京化学同人,2011)では,「これら(3族から12族まで)の元素は一般に遷移元素とされるが,その場合,12族元素は必ずしも含まれると限らない」と記されています。
IUPAC命名法でも「12族は必ずしも含まれない」と明記されていることからも,「12族は遷移元素に含まれない場合がある」と注意書きがされると思います。
「遷移元素」の定義のひとつに,不完全に満たされたd軌道の元素,あるいはそのようなd軌道をもつ陽イオンを生じる元素とありました。
亜鉛の電子配置は,1s22s22p63s23p63d104s2 であることから,不完全に満たされたd軌道をもちません。また,Zn2+になっても電子配置は1s22s22p63s23p63d10であり,イオンになってもd軌道は完全に満たされた状態です。
不完全なd軌道をもつ12族元素(Zn,Cd,Hg)はないのか?
原子核が大きい,同族の「水銀(Hg)」では,d軌道が不完全に満たされるHg3+やHg4+の報告例があります(極低温下において存在)。(参考文献:Mercury Is a Transition Metal: The First Experimental Evidence for HgF4)。水銀の場合,原子核が大きいため本来完全に満たされて安定なd軌道から電子を引き抜くことが可能ではないかと報告されています。(相対論効果もチェックしましょう)
ただ,水銀と違って原子核が小さい亜鉛原子では,閉殻構造となったd軌道から電子をさらに引き抜いてZn3+にするのは困難だと考えられます。
2021年5月にNanoscaleという雑誌で,Zn(BeB11(CN)12) と Zn(BeB23(CN)22)というZn錯体において,ZnがZn+3で存在することが計算科学の論文ですが報告されました。(参考文献:Realization of the Zn3+ oxidation state)。

最新研究を踏まえて,定義も更新されるべきなので,我々教員も日々学び続ける必要を感じています。
分子軌道については別の記事で説明しますね。
雑学 (今後追記あり)
主量子数・方位量子数・磁気量子数
殻(K殻,L殻,M殻等)と軌道の種類(s,p,d軌道)と軌道の数(s軌道は1種類,p軌道は3種類など)の関係は,下記の動画で説明しています。算数がわかれば理解できます。(06:17頃から,それぞれの関係式を説明しています。)
殻の名称 (なぜ,K殻からはじまった?)
尚,原子核が「A」ではなく「K」から始まるのは,特性X線を発見しノーベル賞(1917年)を受賞したチャールズ・バークラが,K殻とした殻の内側に殻がある可能性を考慮して,アルファベットの中間の「K」を殻の名称につけたのが由来となっています。[参考文献: The Spectra of the Fluorescent Röntgen Radiations] なお,欧米では,K殻を「1 shell」,L殻を「2 shell」と呼ぶこともあります。