当ラボには教員志望の学生さんが所属しています。ありがたいことに当ラボから教員を輩出する機会が多くあります。>> 2021年度教員採用試験 ・2020年度教員採用試験・進学・就職先
導入
学生さんや本ブログに訪れる方のために「新学習指導要領の高校理科(化学)」について論じす。また,その単元の【背景知識】を提供できうるブログとして書いています。授業の背景知識にでも。
「私の説明なんて聞きたくないという人(苦笑)」は,
「資質・能力」を育む高校化学 探究で変える授業実践という書籍がおススメです。
>> こちらにリンク貼っておきます。
▼
対話形式(教師と生徒)であり「板書計画」や「単元の評価基準」の作成に便利です。
Kindleでも読めます。
さて,

研究を通した多角的な物事の捉え方や大学で学ぶ教育と最新研究の関連性の考察に加えて,学校教育に関しても,学生さんと一緒に学び,生徒にとってより良い教育を提供できればと学生さんと一緒に考えています。
学生さんの個性的なキャラを活かしながら。
さて,2018年に「高等学校学習指導要領解説」が公開され。2020年度より移行期間に入り、2022年度の高校1年生から【新しい】学習指導要領が始まります。年次進行なので,高校3年生が大学受験を受ける2024年度(2025年1-3月)には「新しい学習指導要領」に沿った入試問題に【完全移行】する可能性が高いです。
YouTube等でも多くの授業が提供され,塾でも対策を立てるはずです。2024年度の受験生さんは,【新】学習指導要領の内容も学んでおいた方が無難だと思います。
そういった意味でも,
新学習指導要領の「理科(化学・化学基礎)に関する改訂」についてまとめてみよう
と思った次第です。
新学習指導要領の改訂資料のアクセス先等
早速ですが「新学習指導要領」の改定の分析”7選”を覚書として論じていきます。
文部科学省のアクセス先は>> 「【理科編 理数編】高等学校学習指導要領(平成30年告示)解説 」
※ 文化省がURLを変更するので2022年2月2日にダウンロードした資料「【理科編 理数編】高等学校学習指導要領(平成30年告示)解説」をサーバーにも置いておきます。
下記,改定内容を記載しますが,書きやすい順で書いています。
① エンタルピー・エントロピーの必修化
【該当箇所】指導要領 P102 (2) 物質の変化と平衡 (ア) 化学反応とエネルギー ㋐ 化学反応と熱・光

大学1年生の「熱力学」で学んでいる【エンタルピー】と【エントロピー】を高校化学で学び始めます。これは,お祝い🙌することであります。「世界の常識・日本の非常識」のひとつである【熱化学方程式】が削除されるからです。そして,エンタルピーで「化学反応と熱」を教えることになります。
熱化学方程式の「何が問題」であったか?エンタルピーがなんであるか?そして,「具体例による理解」は下記のYouTube動画をご笑覧ください。(※サムネイル画像って難しいですね・・・)
▼
尚,ざっくり「熱化学方程式」と「エンタルピー」の違いを説明すると
- 反応式と熱の書き方が違います。
- 熱の「プラスとマイナス」が違います。
「熱化学方程式」;N2+3H2 = 2NH3 + 92 kJ
「エンタルピー」;N2+3H2 = 2NH3 ;ΔH = – 92 kJ
YouTube動画では「エンタルピー」について主として論じていますが,「エントロピー」については【深く】は論じていません。一方,学習指導要領にあるように,反応の進行を決める要因として「エントロピーが増大する方向に反応が進行することに触れる」とあります。
これは,どういう意味かというと,
▼

上記のYouTube動画(16:06)から説明しているように,発熱反応と吸熱反応の自発的な変化(反応が進む方向)はエンタルピーだけで決まりそうなんですが,そうではなく「反応の自発性にはエントロピーが関与してくること」を論じています。
反応の自発性は,エンタルピーだけでは判断できません!
ここ大事!
発熱反応と吸熱反応をエンタルピー変化で説明すると,生徒や学生は「発熱反応が自発的に進みそう」とイメージしちゃいます。これを,きちんと「そう見えるけど,エンタルピーだけでは自発性を判断できない」と強調してあげないと,「生徒さんのイメージ」と「教員の説明」に解離が生じて,何を言っているのかがわからなくなると思います。
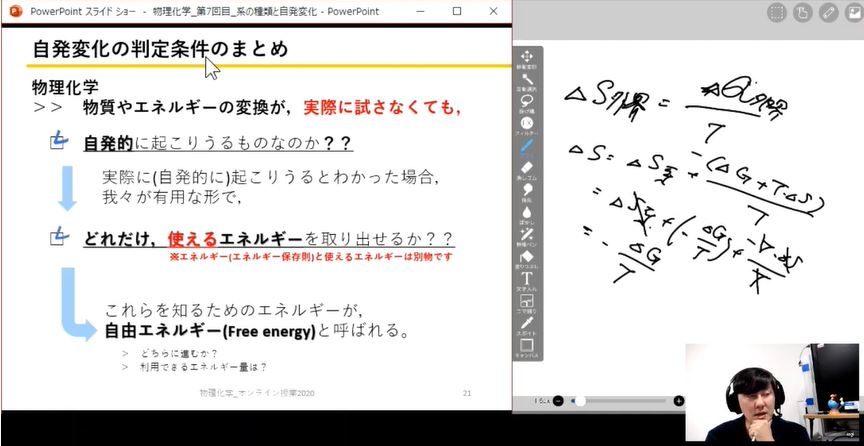
反応の自発性を論じるのであれば,エンタルピー変化(ΔH)とエントロピー変化(ΔS)が関与してくるギブズエネルギー変化(ΔG = ΔHーTΔS)の式まで説明したほうが「スッキリ!」するとは思います。ただ,ギブズエネルギーまで説明を広げると,「化学の単元が広すぎるんじゃないかな~」という気もしています。
> ギブズエネルギーに関するYouTube動画はコチラです。ギブズエネルギーとは何なのかについて論じています。
▼
さて
単元が広すぎるかもしれないということで,

もしかしたら,① 自発的に進む吸熱反応の「代表例」をいくつか出して,② 吸熱反応でも自発的に進む理由を,出発物質に対して目的物質の「乱雑さ」が増大する方向に進むことで説明するのかな?
その時の温度の関わり方は?
そこで,下記の指導案を考えてみました。他で試してみたところ,評判は良かったです。
エンタルピーとエントロピーの関係の指導方法(案)
学習指導要領にあるように「吸熱反応が自発的に進む要因に定性的に触れる場合は,エントロピーが増大する方向に反応が進行することに触れる。」とあるように,反応の【自発的】【非自発的】を指導する必要があるかと考えます。
上記で紹介したYouTube動画の一場面(10:00)を示します。
▼
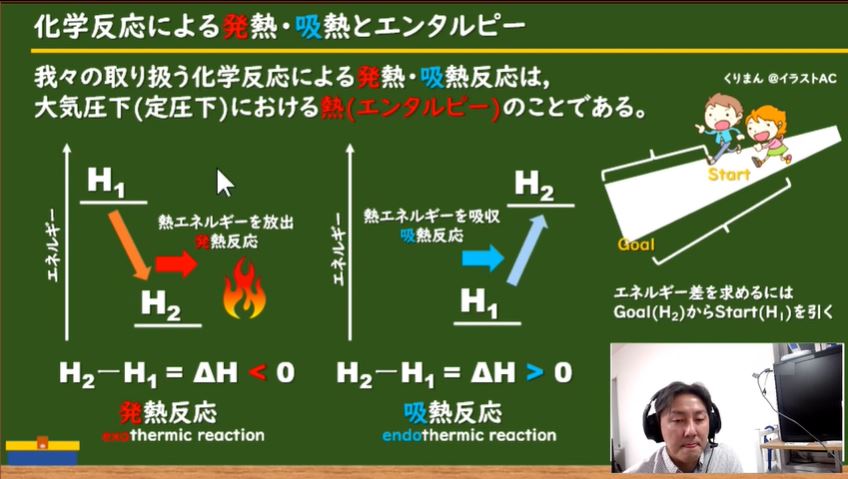
発熱反応は熱エネルギーを放出します。エネルギーの高い状態(H1)からエネルギーの低い状態(H2)に移動する際にエネルギー差を放出します。
エネルギー差(ΔH)は,終点から始点を引きます。
ΔH = H2 ー H1
ΔHが「負」の時が,発熱反応です。同様に考えると,吸熱反応のエネルギー差は(ΔH)は「正」です。
さて,エンタルピーのみで【自発】【非自発】を判断しようとすると,「水が上から下に自発的に落ちる」ように発熱反応が【自発的に】起きるような気がします。(※エンタルピーのみで自発か否かは判断できません)。
発熱反応が自発的に起きそうだけど,そうではない! 吸熱反応の具体例を出す。
あるいは,可逆反応を例に出します。
中学理科で学習する「塩化アンモニウムと水酸化バリウムの反応」は吸熱反応ですが自発的に進みますよね。この吸熱反応を利用したのが「叩けば冷える!瞬間冷却剤」です。教材としても便利です。
動画でも紹介していますが,吸熱反応なのに自発的に進む反応の代表例として,氷から水になる融解反応があります。この融解現象は,ご存知の通り自発的に進みますよね。固体に比べて気体の方が水分子の乱雑さが増すため,吸熱反応でも自発的に反応が進むとも言えます。
H2O(固体) → H2O(液体) ; ΔH = 6.0 kJ/mol (吸熱反応)
つまり,この段階で,生徒に対して次のことをポイントとして伝えられます。
- 発熱反応や吸熱反応のエンタルピー変化だけでは,反応が自発的に進むかどうかは判断できない。(吸熱反応でも,自発的に進む反応が身近にある。)
この氷の融解反応について,生徒に対して問いかける重要なポイントがあります。
この融解反応を止めるには,どうすればよいか?
この反応を止めるには「冷凍庫」を使えばいいんです。冷凍庫の中では,自発的に氷は水になることなく固まったままです。つまり,温度(T)が「自発的に進むかどうかのエントロピー」に関与してくることがわかります。
吸熱反応である氷の融解は,氷から水になるエントロピー(乱雑さ)の増加という要因が大きく,室温では熱を吸収するアップヒルの吸熱反応でも自発的に進みます。一方,温度を下げることでエントロピーによる要因が抑えられるというイメージが付くかと思います。さらには,「自発か否か」はエンタルピー変化とエントロピー変化のバランスで成り立っているというイメージもつくかと思います。
先ほどの,生徒に対する自発か否かの最終的なポイントは
- エンタルピー変化(発熱反応や吸熱反応)だけでは,反応が自発的に進むかどうかは判断できない。(吸熱反応でも自発的に進む反応が身近にある。)
- 温度(T)はエントロピー変化(ΔS)と深い関係がある。
- エンタルピー変化(ΔH)と温度で変化するエントロピー変化(ΔS)のバランスにより自発か否かを判断できる。
結果として,このポイントを踏まえて「反応が自発的に進むかどうか」を判断する式としてギブズエネルギー (定圧下条件) を提示する流れはでしょう。自然かと思います。
ΔG = ΔHーTΔS
ΔG<0 自発的な変化
ΔG>0 非自発的な変化
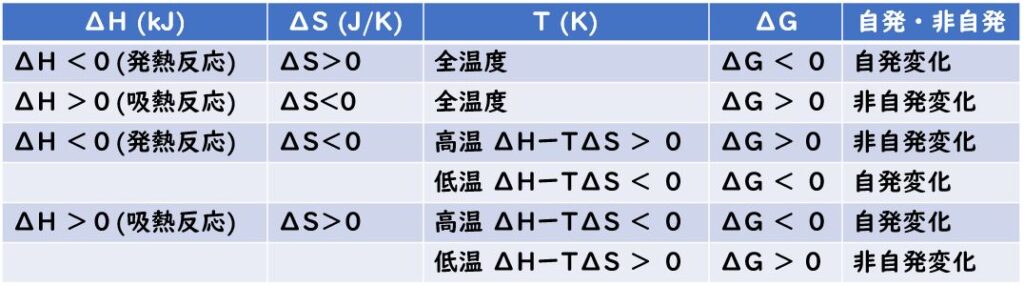
安易に上記の表を覚えさせ,反応の自発的な変化についてギブスエネルギーの変化として暗記させるのではなく,エンタルピー変化とエントロピー変化のバランス,さらには温度で変化するエントロピー変化までを理解させることで,ギブズエネルギーの式の深い理解へとつながるのではないかと考えています。
エンタルピーやエントロピーに関する参考書の紹介
化学を教える先生が,大学物理化学を復習するにはやはりアトキンス物理化学かと思います。私が学生の頃は白黒で「かかってこぃ」という様相で説明もわかりずらかったですが,現在「フルカラー」に生まれ変わり,説明はわかりずらいです。
【参考文献】下記の3種類の書籍を紹介いたします。
- 物理化学の基礎(アトキンス) (復習には最適ですが,歯ごたえが弱い。)
- アトキンス物理化学要覧 (字がちっさい。目が渋々します。)
- アトキンス物理化学(上) (わかるとめちゃおもろい。最高!)
「アトキンス」で検索すると,下記のおいしそうなお菓子がヒットしますよね。
アトキンス キャラメルナッツチューバー
感染症が落ち着いてアメリカの学会で,本場のアトンキンス ニュートリッショナルズ社(Atkins Nutritionals)を食べたいですね。一応,ダイエット食品ですよ。 復習するには脳への「糖分」供給が必要ですからご賞味くださいね。
② 電気分解と電池の順番が逆に!
【該当箇所】(2) 物質の変化と平衡 (ア) 化学反応とエネルギー ㋐ 化学反応と熱・光


新学習指導要領では「電池」「電気分解⚡」の順番になります。「ダニエル電池」が化学基礎に移動します。(※「ボルタ電池」は消えちゃうのかな??そわそわ。)
▼
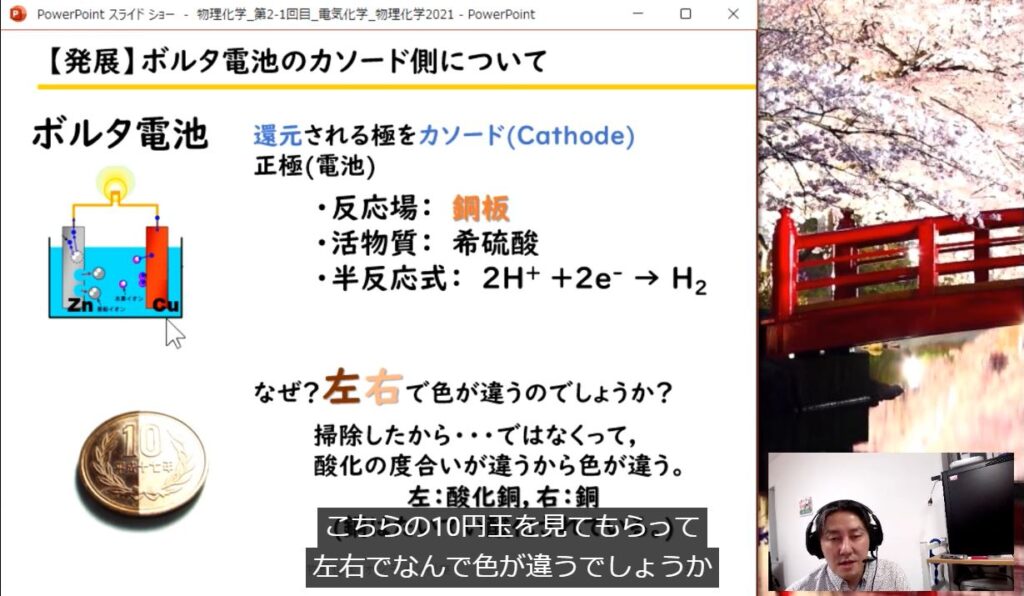
ボルタ電池は,昔習ったような単純な反応が起きているわけではなく,様々な反応が起きているので,消えゆく運命にあります。
「化学」では「代表的な実用電池を扱う」と記載があるので,
- ガストン・プランテ先生による二次電池の鉛蓄電池
- 屋井先蔵先生の乾電池
- 吉野彰先生のリチウムイオン電池
- 水素と酸素から水を作る燃料電池 (原理はハンフリー・デービー先生が考案しました。デービーさんは何でもできちゃいますね。)
でしょうかね。
個人的には,「電池」をやってからの「電気分解」の方がわかりやすいのではないかと考えています。正極と負極と陽極と陰極の違いをよく分かっていない学生さんもチラホラ散見します。この「電池」と「電気分解」についても,YouTube動画があるのでコチラをご笑覧いただければ幸いです。なお,電池は標準電極電位がイオン化傾向と同じだとわかれば暗記する必要はなく電池の原理を理解できます。

ここまでの感想としては,「知識を蓄える教育」から「知識の使い方の教育」への移行がうかがえます。
「化学基礎」と「化学」の共通目標として「いくつかの事象が同一の概念によって説明できることを見出したり,概念や原理・法則を新しい事象の解釈に応用」とあります。
いずれにしろ,物理(化学)寄りに近づいている印象があります。原理・法則がわかったほうが学んでいても楽しいし,応用もききますからね。
③ Fe(OH)3の表記がなくなる(らしい。)
【該当箇所】なし; P102 ㋑溶液とその性質について 「コロイド」の記述あり
コロイド溶液の性質や調整方法において,受験化学として頻出問題であった赤色粒子の水酸化鉄(III)の「Fe(OH)3」の表記がなくなる(らしい。)(※ 教科書を取り寄せ中)
表記がなくなる理由は単純です。赤色粒子が水酸化鉄(III)(;Fe(OH)3)ではないからです。水酸化鉄といっている赤色粒子は,酸化水酸化鉄(;FeO(OH); 2FeOOH = Fe2O3・H2O)と酸化鉄(III)(;Fe2O3)の混合物と言われています。[参考文献:Ferric hydrous oxide sols: III. Preparation of uniform particles by hydrolysis of Fe(III)-chloride, -nitrate, and -perchlorate solutions1,2]
さて,学校で実験がしやすい水酸化鉄のコロイド実験は受験に頻出な問題です。一方で,Fe(OH)3の表記がなくなり,正式なFeOOHとFe2O3の混合物として教える場合,これまでの「正確ではない」反応式を教えることは出来なくなります。では,そのあたり「正確ではない反応」と「実際に起きているであろう反応」を論じたいと思います。詳しくは参考文献を読んでみてね。
実際,どんな反応が起きているの?
受験化学としての水酸化鉄(III) (教科書から消える予定)
沸騰した水(H2O)に,可溶の黄色い塩化鉄(III) (; FeCl3)の飽和水溶液を加えます。滴下すると,すぐさま水に不溶の赤色の水酸化鉄(III)コロイド溶液ができます。

反応式:FeCl3 + 3H2O → Fe(OH)3 + 3HCl
昔の記憶では,反応が早いので大きな粒とならずに,コロイドとして液中に漂うみたいな感じだったような気がします。この赤いコロイド溶液を使って「チンダル現象」や「凝析」を学びます。
実際のFe(II)とFe(III)の反応 (参考文献を参照のこと)
実験方法としては,同じですが反応式が異なってきます。水酸化鉄に関する内容は,「錆び(さび)」とともに学びます。「知られざる鉄の科学」に記載のとおり,人類は鉄とともに文明を気づいてきたかと思います。何よりも,刀の作り方を知ったときは・・・・脱線したので話を戻しましょう。
鉄は水中で錆びる(酸化)ことで,水酸化鉄(II)と呼ばれる腐食物が表面に生じます。この腐食生成物は,鉄イオンと水酸化物イオンが反応することで,白色から緑色の生成物になります。この水酸化鉄(II)は水中の酸素と反応して,水酸化鉄(III)(;Fe(OH)3)を経て,すぐさまオキシ水酸化鉄(; αーFeOOH,黄色・褐色)となります。この時,水中の酸素が少ないと,結晶多形のオキシ水酸化鉄(; γ-FeOOH,黄褐色・茶色)になることが報告されています [参考文献:Über Das Ferrohydroxyd (Eisen-2-hydroxyd)]。
これらのオキシ水酸化鉄が脱水することで,ヘマタイト(赤鉄鉱; α-Fe2O3)となります。また,ヘマタイトを還元することでマグネタイト(黒錆; Fe3O4)となります。
Fe(II)の反応: Fe(II) → Fe(OH)2 → Fe(OH)3 → FeOOH (Fe2O3・H2O)→ Fe2O3 → Fe3O4

赤い土壌はヘマタイトです。しかし,装飾品レベルのヘマタイトはブラックダイヤモンドと称されるほど,かなりカッコ良い石です。

マグネタイトは人類が初めて手にした「磁石」として知られています。あるいは,日本刀を作るうえで利用してきた「砂鉄」でもあります。
なお,意図的に酸化させて黒錆による酸化被膜コーティングしたものが「黒いフライパン」です。
一方,FeCl3を含む水溶液では次の反応を進むことが知られています。[参考文献:Kinetics of ferric oxyhydroxide precipitation]
FeCl3 + 2H2O → FeOOH + 3HCl
Fe(II)はFe(III)に酸化されやすく,Fe(III)を用いた場合でも,オキシ水酸化鉄が形成されることがお分かりになるかと思います。
Fe(III)の反応: Fe(III) → FeOOH (Fe2O3・H2O)→ Fe2O3 → Fe3O4
コロイド溶液が形成される理由
さて,Fe(III)が水溶液中でコロイドになる理由を論じていきたいと思います。Fe(II)およびFe(III)は,基本的には6配位の八面体構造をもちます。水中では,6つのH2Oが配位しています。水の酸性度によっては,配位子のH2OのH+が抜ける加水分解反応(H2O → OH– + H+)が進み,OHとして配位することになります。
[Fe(OH2)6]3+ + H2O → [Fe(OH)(OH2)5]2+ +H3O+
[Fe(OH)(OH2)5]2+のOHとH2Oが脱水縮合することで二量体を形成します。この金属イオンが2核のアクア錯体はコバルト(; Co)でも報告例があります。[参考文献: A novel microporous hydrogen-bonding framework constructed with tetrathiafulvalene tetracarboxylate ligand: Synthesis, structure and magnetic properties]
[Fe(OH)(OH2)5]2+ + [Fe(OH)(OH2)5]2+ → [Fe2(OH)2(OH2)8]4+ + 2H2O
この二量体がさらに縮合を繰り返すことで,オキシ水酸化鉄(; FeOOH)になると報告されています。[参考文献①:腐食反応に対するアニオン効果の序説,参考文献②:Hydrolysis of inorganic iron(III) salts,参考文献③:Sol-Gel Science: The Physics and Chemistry of Sol-Gel Processing]
[Fe(OH)(OH2)5]2+ + [Fe(OH)(OH2)5]2+ → [Fe2(OH)2(OH2)8]4+ + 2H2O → FeOOH
オキシ水酸化鉄(FeOOH)は,二量体が存在する溶液中での環境(pH)により最終的な構造である(αー,β,γー,εー)といろいろな結晶構造をとります。オキシ水酸化鉄の分子構造を見てもらえればわかりますが,酸素分子を介したポリマー鎖や面のような構造をもっています。
>>「FeOOHの分子構造 参考文献(Fig. 1参照):First principles calculations of surface dependent electronic structures: a study on β-FeOOH and γ-FeOOH]
この反応が進んだ結果、ナノサイズ以上に成長することで水に不溶なコロイド粒子になります。
④ 核酸が「化学」から「生物」へ移動っぽい。
下記に記すように,【旧】学習指導要領に記載のあった「核酸」が【新】学習指導要領では削除されています。代わりに【新】学習指導要領の「生物」に「核酸」「DNA」「RNA」の記載が多く見られます。
化学の新旧の該当ページ
【該当箇所】(4) 有機化合物の性質 (イ) 高分子化学 ㋑ 天然高分子化学

(新) 高等学校 学習指導要領 理科編 P 109-110

生物の新旧の該当ページ
【該当箇所】 (2)生命現象と物質 (ア)細胞と物質 ㋐生体物質と細胞

(新) 高等学校 学習指導要領 理科編 P 135

生物でやりましょう!という考えでしょうか。
⑤ マグネシウムがアルカリ土類元素に分類
【該当箇所】P106 (3) 無機物質の性質 (ア) 無機物質 ㋐ 典型元素について

周期表の第2族元素は,ベリリウムBe,マグネシウムMg,カルシウムCa,ストロンチウムSr,バリウムBa,ラジウムRaです。このうち,【旧】学習指導要領ではベリリウムBeとマグネシウムMgをのぞいた4元素(Ca, Sr, Ba, Ra)を【アルカリ土類元素】と呼んでいました。
2005年のIUPACの勧告に沿って,マグネシウムはアルカリ土類元素に分類されました。ただし,IUPAC命名法(化合物命名法:IUPAC命名法に準拠),東京化学同人,2011)では,「2族のすべてがアルカリ土類金属」となっています。。
炎色反応はどうなるのかな?

アルカリ土類金属といえば炎色反応を示すのが特徴でしたね。カルシウムは橙赤色,ストロンチウムは紅色,バリウムは黄緑色です。マグネシウムは,強い白色光なので炎色反応を示しません。
ひっかけ問題でしょうね。
Be(;ベリリウム)もマグネシウム同様に「白色光」なので炎色反応は示しません。。教科書では,ベリリウムとマグネシウムをアルカリ土類金属の「例外」として記述されると考えられます。
⑥ 原子軌道(s軌道,p軌道,d軌道)を教える
【該当箇所】P106 (3) 無機物質の性質 (ア) 無機物質 ㋐ 典型元素について

学習指導要領には,「カリウム原子では,M殻が最大収容数の電子で満たされる前にN殻に電子が収容される理由や,塩化物イオンでは,M殻が最大収容数の電子で満たされていなくても安定に存在できる理由に触れることも考えられる」と書かれていますよね。
M殻には「18の電子」が収容することができるのですが,M殻に「8個の電子」が収容された途中の段階で,次のN殻に電子が収容され始めます。これをきちんと説明するにも,原子軌道の説明をする必要があります。YouTube動画に原子軌道の説明を上げていますが,これについても別の記事で説明したいと思います。
▼

⑦ 12族の亜鉛(Zn)が遷移金属に!!
【該当箇所】P107 (3) 無機物質の性質 (ア) 無機物質 ㋑ 遷移元素について

この変更は,2015年以降のIUPAC命名法(化合物命名法:IUPAC命名法に準拠),東京化学同人,2011)では,「これら(3族から12族まで)の元素は一般に遷移元素とされるが,その場合,12族元素は必ずしも含まれると限らない」とされているからです。
これに関しては,IUPAC命名法でも,「12族は必ずしも含まれない」と記載されていることからも,「12族は遷移元素に含まれない場合がある」と注意書きがされると思います。
この亜鉛が「遷移」元素になるのは,なかなか気持ち悪いものです。
亜鉛(Zn)・カドミウム(Cd)・水銀(Hg)の第12族元素は,化学的性質が典型元素に似ており,イオン化してもd軌道の10電子が閉殻していることから,IUPACの典型元素に分類されますが,命名法としては遷移元素に分類されています。
どっちやねん!!
なお,後述しますが,そもそも「d軌道」という単元は高校化学に含まれていないことからも,遷移元素の定義を説明するのは難しいです。また,d軌道の電子が他のd軌道に移動することを「d-d遷移」といいます。このd-d遷移のエネルギーがちょうど「可視領域の波長のエネルギー」と似ているために,遷移元素は色をもちます。
当然,d軌道が閉殻している12族のZn,Cd,Hgも無色(銀白色)です。また,Zn2+,Cd2+,Hg2+のイオンになってもd電子は閉殻しているのでd-d遷移が起きずに無色です。
本当は,このd軌道が閉殻している辺りを説明できれば,かなり理解が進みます。
この辺りは,すでに本ブログがさらに長くなる理由となりますので,別のブログで書きたいと思います。なお,「d電子が閉殻しているから12族を遷移元素にするのは間違えている」という意見がありますが,「11族のAg+もd電子が閉殻しています」ので,なかなか定義というのは難しいものです。
また,HgF4というHg4+の報告例もあることからなかなか長文になりそうでしょ?
※別の記事で「原子軌道」や「d軌道」も含めて書きます。>>> 別の記事
⑧ 混成軌道(sp,sp2, sp3)を教える
【該当箇所】P108 (4) 有機化合物の性質 (ア) 有機化合物 ㋐ 炭化水素について

「炭素原子の電子配置の資料を示して,メタンが正四面体形である理由について,電子配置と構造を関連付けて」
とあることからも,混成軌道を教えないとメタンが正四面体構造になる理由は説明できませんよね。この混成軌道についても,追って論じていきたいと思います。
混成軌道を教える上では,黒板では難しいです。分子模型の登場でしょう。
水素がコロコロ転がりますし,結合の棒が抜けなくて指痛くなりますが,正四面体等の立体構造を理解するには模型が必要だと思います。
※別の記事でVSEPR理論と混成軌道も含めて書きました。>>> こちら
皆さまの教育に役立てばと思います。
新学習指導要領が受験に関係してくる頃 年次進行のお話し
※年次進行の説明※ この年次進行のイメージが湧かない生徒さんに説明すると,2022年度で高校2年生の生徒さんは【旧】学習指導要領にそった授業を受けます。ただ,1個下の高校1年生は【新】学習指導要領にそった授業を受けます。つまり,同じ学校に【新】学習指導要領の生徒と【旧】学習指導要領の生徒がいるということです。
2022年度に高校2年生の方は,2023年度(2024年1-3月)に現役として受験をしますよね。浪人した場合,2024年度(2025年1-3月)に一浪として受験します。2024年度のテストは,【新】学習指導要領の内容が入ってくるかもしれないということです。「かもしれない」と書くのは,大学としても「旧学習指導要領をうけた浪人生」を考慮する可能性がありますので,すべてのテスト問題を一気に【新】学習指導要領に沿わせないかもしれません。ただ,新学習指導要領で新たに追加された内容は教科書や参考書の「発展」にすでに書かれていることが多いのも事実です。
つまり,やっておいて損はありません。



















[…] ②については,「熱化学方程式」を代表とする【日本の高校生だけが学ぶ単元】をなくし,日本の大学での教育および,当然のことながら海外の大学進学も視野に入れたグローバルに通用する教育かと思います。>> 熱化学方程式の問題点のブログはコチラ,YouTube動画はコチラ […]
[…] > 理科(化学) 改訂8選 と背景知識をまとめています。 > コチラ […]
[…] 新課程で変更になった内容を8個選んで詳しく解説 > コチラをクリック […]