さて,前々回の記事で,新学習指導要領の変更点(8選)についてまとめました。この新学習指導要領(文部科学省リンク)は,2022年4月に高校1年生になる生徒が対象です。
年次進行で新課程へと変更されるので,受験に完全に影響するのは2024年度(2025年1-3月)だと思います。しかし、2022年度のとある私立の工業大学で「ギブズエネルギー」が入試問題に出題されています。※Twitterで検索すれば出てきますよ。
やっておいて,損はありません!ってことで。
前座がいつも長くなるので,目次で「混成軌道(改定の根拠)」まで飛んじゃっても大丈夫ですからね。
はじめに

入試問題に出ないから勉強しなくても良いでは,ありません。
今回の変更点は,諸外国とは真逆の事を教えていたことの修正や暗記一辺倒だった単元の原理の学習です。
理由がわからずに,受験のために「覚える」のは知識の定着に悪いです。
きちんと,内容を理解することで知識の定着も促せますし,何よりも【応用問題】に対応できるようになります。
高大接続という改革が行われています。高等学校教育と大学教育および大学入学選抜(試験)の一体化の改革です。今回の学習指導要領の改訂は,高大接続改革の重要な位置づけと言われています。
- 子どもたちに求められる資質・能力とは何かを社会と共有する。
- 連携する社会に開かれた教育課程を重視
- 旧学習指導要領の枠組みや教育内容を維持したうえで,知識の理解の質をさらに高め,確かな学力を育成
新学習指導要領は,上記3点の基本的な考えのもとに作成されています。
理系学生および高校教員志望へ
新学習指導要領の変更点は大学で学びます。
高校で習っただろうけど、あれ日本だけでやっているから~~
とか
高校では暗記だったけど,大学では「なぜ?ああなるのか?」を理解できるよ
などなど。大学での学びは面白いです。
今回の改定については,同級生は当たり前のように知っているかもしれませんし,浪人すればなおさら関係してきます。
また,高等学校の教員を目指すのであれば,内容を理解して「教え方」を考える必要があります。
本ブログ内容が皆さんの助けになればと思っています。
これまでの関連記事と学習補助教材
前々回の記事で,新学習指導要領の変更点(8選)についてまとめました。背景知識も含めて,細かく内容をまとめましたが長文となり,ブログ投稿を分割しました。
前回の記事で,原子軌道と分子軌道(混合軌道)をまとめるつもりが。また,長文となってしまいました。
ただし,前回の記事は「ゼロから原子軌道がわかる」ように論じたので,原子軌道の教え方に悩んでいる方?を対象に読んでいただけると嬉しい限りです。
さて,本ブログの本題である「分子軌道(混成軌道)」に入ります。前置きが長くなっちゃう傾向があるんですよね。すいません。
学習補助教材 分子模型
なお,下記をお読みいただければお分かりのとおり,混成軌道(σ結合やπ結合)を学ぶと考えられます。その際に,学習の補助教材として必要となってくるのが「分子模型」でしょう。
立体構造は,実際に見たほうが理解が早い! です。
言わずもがな,丸善出版が倒産の危機を救った「HGS分子模型」です。一度,倒産したんだっけかな?
有機化学学習セットは,「高校の教科書に出てくる化学式の90%が組み立てられる」とあります。
おススメは,HGS分子構造模型 B型セット 有機化学研究用です。分子模型は大学でも使ったり,研究室でも使ったりします。
ちょっと値段が張りますが,足りなくて所望の分子を作れないよりは良いかと思います。
ただし,HGS分子模型の「デメリット」がひとつあります。
原子の球から結合の「棒」を抜くのが固い!
触ったことがある人は、皆さんがあの固さを思い出します。
値段が高くても良い場合は,原子軌道や分子軌道の「立体構造」を理解しやすい模型が3D Scientific molymodから発売されています。
色もかわええですが,ちょい高めです!
混成軌道(新学習指導要領の自選⑧番目;改定の根拠)
メタンの正四面体構造 (分子軌道)
【該当箇所】P108 (4) 有機化合物の性質 (ア) 有機化合物 ㋐ 炭化水素について

エネルギー資源としてメタンハイドレート(メタンと氷の混合物)があります。日本近海での埋蔵が確認されたことからも大変注目を浴びています。水によるダイヤモンドのような構造の中にメタンが内包されています。
>> MH21-S (砂層型メタンハイドレート研究開発)
学習の順序 (旧学習指導要領 vs 新学習指導要領)
結論から言うと,メタンの正四面体構造を説明するには「混成軌道の理解」が必要になります。
▼
学習の順序(探求の視点)を説明します。「混成軌道の理解」が必要な理由もわかります。
1.「化学基礎」で学習する電子殻では「M殻の最大電子収容数18を満たす前に,N殻に電子が入り始める理由」を説明できません。
前回の記事で説明したように,この理由は原子軌道(s,p,d軌道)の理解が必須です。また,ご存知の通り,新学習指導要領では原子軌道についても学習します。詳しくは,前回の記事をご覧ください。
新学習指導要領では,原子軌道(s軌道・p軌道・d軌道)を学びます。
2.「化学基礎」の電子殻の知識によって,水分子・アンモニア・メタンの「分子式(ルイス構造)」を説明することは出来ます。しかし,分子の【立体構造】を説明できません。
3.また,新学習指導要領で学ぶ「原子軌道」の知識でも,分子の【立体構造】を説明できません。
電子殻(K殻,L殻,等)と原子軌道では,分子の立体構造を説明できません。
分子の立体構造を理解するには,①電子式から分子構造を理解するVSEPR理論,②原子軌道からの混成軌道(sp3,sp2,sp混成軌道),の二つの方法があります。
▼
分子の立体構造を説明方法
VSEPR理論 (Valence-shell electron-pair repulsion theory)
原子価殻電子対反発理論の略称を,VSEPR理論といいます。長い!忘れる!
VSEPR理論は,第2周期元素によって構成される分子の立体構造を予想することができます。主として出てくる元素は,炭素(C),窒素(N),酸素(O),水素(H)です。
VSEPR理論の考え方
結合している原子と電子対が,中心原子の周りで可能な限り互いに離れて分布するという考え方です。
▼

原子や電子対を風船として,中心で風船を結んだ場合を想像してください。
お互いのバルーンが離れて立体構造を形成することがわかりるかと思います。
様々な立体構造を風船で作ることもできますが,VSEPR理論では下記の3つの立体構造に焦点を当てて考えます。
▼
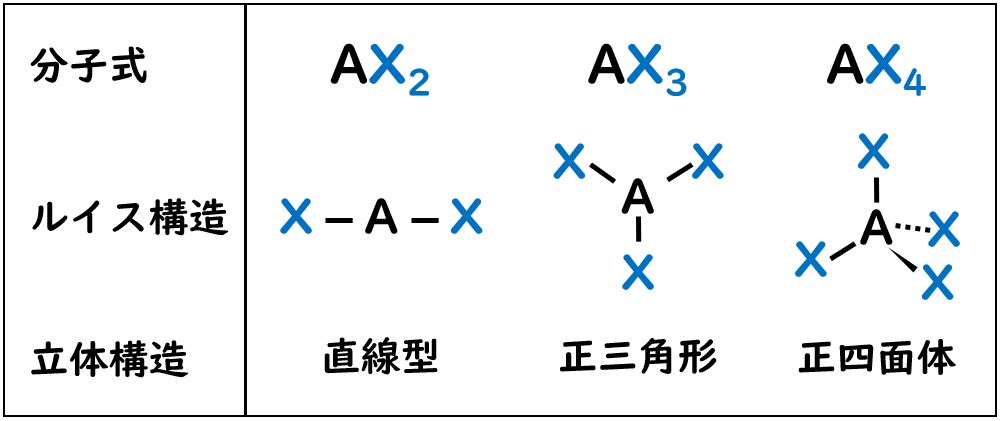
【直線型】の分子構造は,3つの原子が一直線に並んでいます。XAXの結合角は180°です。
_

【正三角形】の分子構造は平面構造です。分子中央に中心原子Aがあり,その周りに三角形の頂点を構成する原子Xがあります。XAXの結合角は120°です
_

【正四面体】の分子構造は,三角錐の重心に原子Aがあります。各頂点に原子Xがあります。結合角XAXは109.5°です。
▼
特に,正三角形と正四面体の立体構造が大事になってきます。
非共有電子対
上記の「X」は原子だけではなく非共有電子対でもOKです。この非共有電子対は,立体構造を考える上では「見えない(風船)」ですが,見えないだけで分子全体の立体構造には影響を与えます。
正三角形と正四面体の分子構造を例にして,この非共有電子対(E)についても見ていきましょう。
直線の分子構造
直線構造になる分子は,
- 中心原子Aが,ふたつの二重結合をもつ
- 中心原子Aが,ひとつの三重結合をもつ
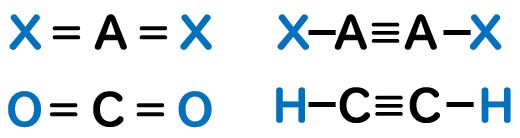
直線構造の分子の例として,二酸化炭素(CO2)とアセチレン(C2H2)があります。
正三角形の分子構造
正三角形の構造が得られるのは、次の二つです。
- 中心原子Aが,ひとつの原子Xと二重結合を形成している
- 中心原子Aが,空のp軌道をもつ (カルボカチオン)
1の二重結合をもつ場合について例を示します。
A=X結合を「芯」にして,非共有電子対の数を増やしました。注目する点は結合角です。AX3とAX2EではXAXの結合角に差があります。
原子が非共有電子対になることで,XAXの結合角が小さくなります。
▼
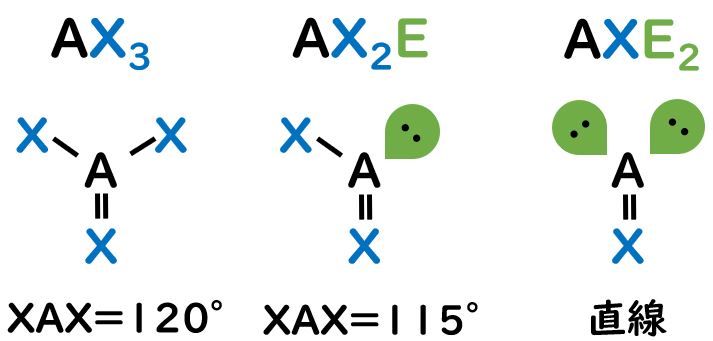
2の例であるカルボカチオンは空の軌道をもつため化学的に不安定です。そのため,よっぽど意地悪でない限り,カルボカチオンで立体構造を考えさせる問題は出ないと思います。カルボカチオンは,反応性の高い化合物または反応中間体として教科書に掲載されています。
正四面体の分子構造
三角錐の重心原子Aに結合した原子あるいは非共有電子対の組み合わせにより,以下の4つの立体構造が考えられます。
▼
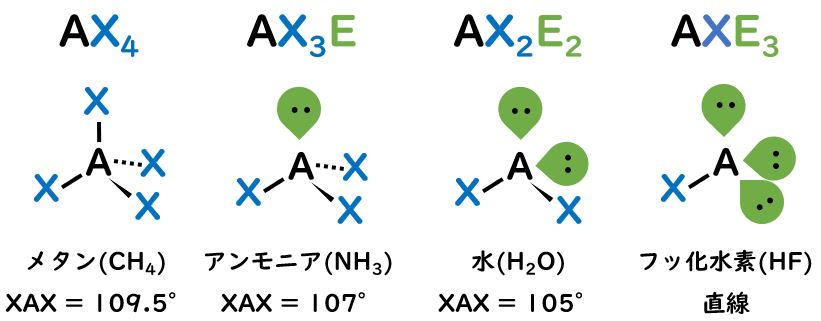
四面体構造になるのは,単結合だけで構成される分子の特徴です。先の三角形の立体構造と同様に,非共有電子対が増えるにしたがってXAXの結合角が小さくなります。
非共有電子対は結合しないので,方向性があいまいであり軌道が広がっているために,結合角をゆがませます。これは,実際に分子模型で組み立ててみるとわかります。
VSERP理論の限界
周期表の下に行けば行くほど原子サイズが大きくなります。大きな原子は小さな原子よりも立体構造をゆがめます。そのため,第3周期以降の原子を含む場合,VSERP理論の立体構造と結合角に大きな逸脱が見られ始めます。
VSERP理論で登場する立体構造は,第3周期以降の元素を含むことはマレです。
混成軌道 (; Hybridization, Hybrid orbitals)
混合軌道に入る前に,これまでに学んできたことをまとめます。
1.VSERP理論によって第2周期元素の立体構造を予測可能
2.原子軌道は,s軌道が球形・p軌道はx,y,z軸に沿って配向したダンベル
>>s軌道・p軌道については下記の画像(動画#2 04:56)をご覧ください。
▼
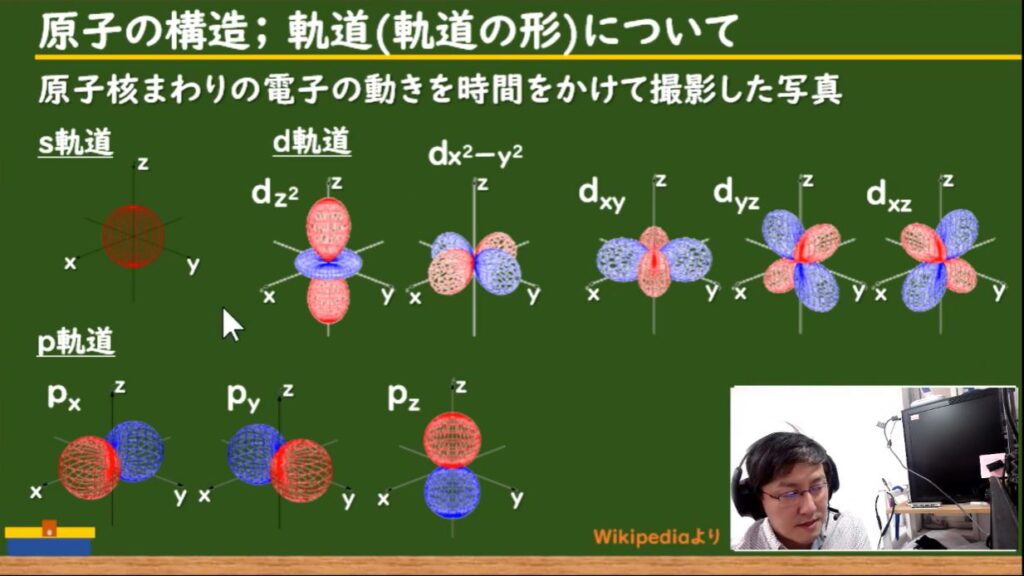
具体例を通して,混成軌道を考えていきましょう。
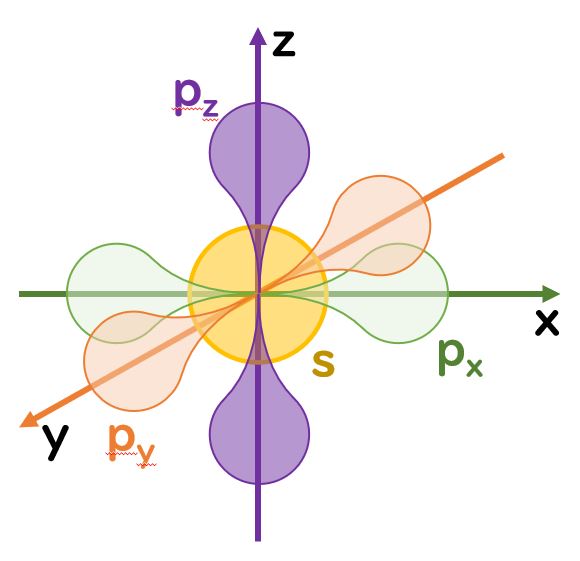
原点に炭素原子があります。この炭素原子に4つの水素が結合したメタン(CH4)を考えてみましょう。
いくつかの問題がおきます。
原子軌道による分子の立体構造の問題
- 原子軌道は互いに90°の関係にあります。VSEPR理論では,メタンの立体構造は結合角が109.5°の四面体であることが予想できます。
- 炭素原子の電子配置は,1s22s22p2です。結合可能な電子は2p軌道の2個だけであり,4個の水素が結合できない。 >> 電子配置の考え方はコチラ
- 実際の4つのC-H結合は,同じ(等価な)エネルギーをもっている。
これらの問題点に解決策を見出したのは,1931年に2度のノーベル賞を受賞したライナスポーリングです。ポーリング博士は,観察された結合パターンを説明するために,結合を「混合」あるいは「混成」するモデルを提案しました。
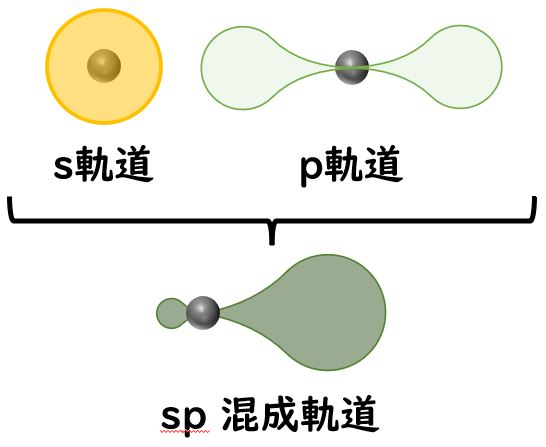
ここで,強調しておくことがあります。
混成軌道は数学的モデルなだけです。原子軌道が実際に混成軌道に変化する訳ではありません。
混成軌道は,観測可能な分子軌道に基づいて原子軌道がどのように見えるかを説明する「数学的モデル」です。
混成軌道の形成
上記を踏まえて,混成軌道の考え方を論じます。
前提として,結合を形成するには2つの電子が必要です。
さて,炭素の電子配置は,1s22s22p2です。px,py,pzは等価なエネルギー準位をもつp軌道です。軌道を四角形(□)で表現して,炭素の電子配置は以下のように書けます。
▼
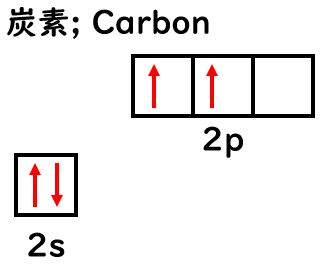
電子配置を考慮すると,2s軌道に2つの電子があり,2p軌道に2つの電子があります。
※なぜ,2p軌道に1個ずつ電子が入るのはフントの規則です。 >> こちらを参考に
炭素には二つの不対電子しかないので,2つの結合しかできない事になります。
重要なので,もう一度書くと
炭素の不対電子は2個しかないので,二つの結合しか作れないはずです。
水素原子が結合する場合,2個しか結合できないので,CH2しか作れないはずです。
しかし,CH4という4つの結合をもつ分子が実際に存在します。
この「2つの結合しかできない電子配置」から「4つの結合をもつ分子を形成する」ためには「分離(decouple)」する必要があります。
▼
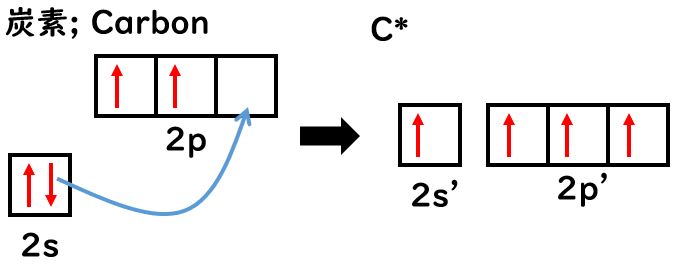
図に示したように,原子内の電子を「再配置」することで,軌道のエネルギー準位も互いに近くなり,実質的に縮退します。(同じようなエネルギーになることを”縮退”と言います。)
この「再配置」によって,混成軌道の形成が可能になります。原子軌道の組み合わせによって,3種類の混成軌道を作ることができます。
▼
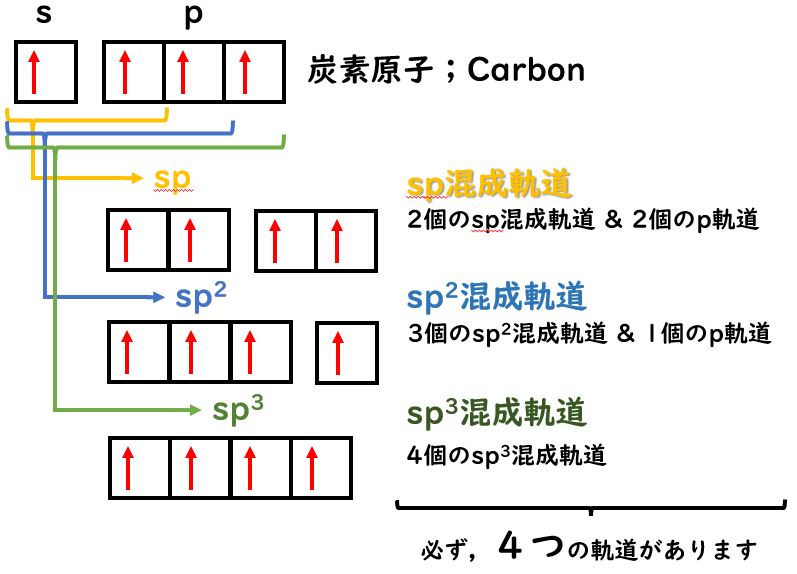
混成軌道において,重要なポイントがふたつあります。
混成前の原子軌道の数と混成後の分子軌道の数は同じになります。
つまり,4つの原子軌道(1つのs軌道と3つのp軌道)から,4つの分子軌道(sp3混成軌道)が得られます。模式図を見てもわかるかと思います。
混成軌道の「残りのp軌道」が π結合する。
sp3混成軌道
1つのs軌道と3つのp軌道を混成すると,4つのsp3混成軌道が得られます。
▼
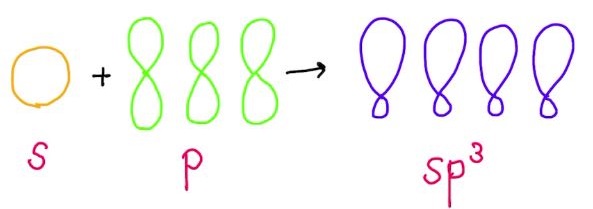
得られる4つのsp3混成軌道のエネルギーは縮退しています。VSERP理論によれば,これらの軌道は互いに可能な限り離れる必要があります。つまり,結合角が109.5°の正四面体構造になります。
▼
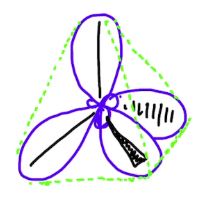
正四面体構造となったsp3混成軌道の各頂点に水素原子が結合したものがメタン(CH4)です。
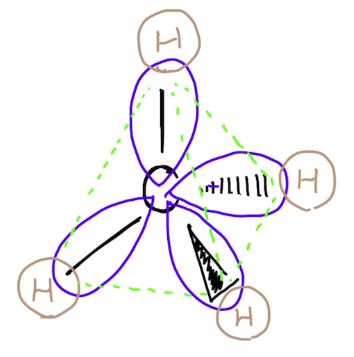
sp2混成軌道
同様に,1つのs軌道と2つのp軌道から3つのsp2混成軌道が得られます。また,混成軌道にならなかったp軌道がひとつあります。
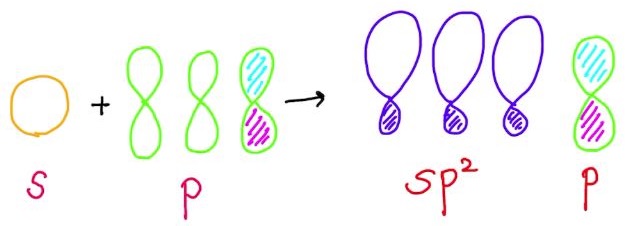
この混成軌道は,中心原子の周りに平面の正三角形が得られ,ひとつのp軌道が平面の上下垂直方向にあります。
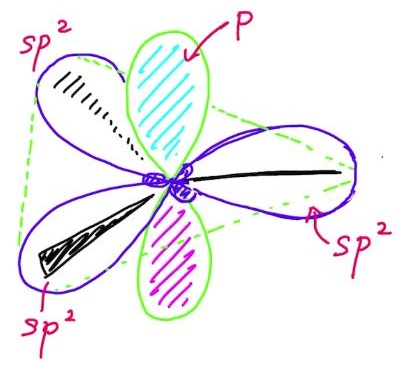

この未使用のp軌道がπ結合を形成します。
例えば,エチレン(C2H4)で考えてみましょう。エチレンのひとつの炭素は,3方向にsp2混成軌道をもちます。
3つの混成軌道の2つに水素原子が結合します。残り1つのsp2混成軌道が炭素との結合に使われます。下記の図で言うと,水素や炭素に結合したsp2混成軌道は「黒い線」です。
ひとつの炭素から三つの黒い線が出ていることがわかるかと思います。この黒い線は,軌道間の重なりが大きいため「σ(シグマ)結合」と呼ばれます。
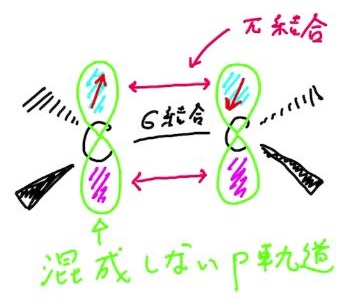

混成軌道に参加しなかったp軌道がありました。この電子をひとつもつp軌道が横方向から重なることで結合を形成します。この横方向の結合は軌道間の重なりが小さいため「π(パイ)結合」と呼ばれます。
つまり,エチレンの分子に見られる二重結合は,
sp2混成軌道による「ひとつのσ結合」 と sp2混成軌道に参加しなかったp軌道による「ひとつのπ結合」
からできています。
sp混成軌道
お分かりのとおり,1つのs軌道と1つのp軌道から2つのsp混成軌道が得られ,未使用のp軌道が2つあります。
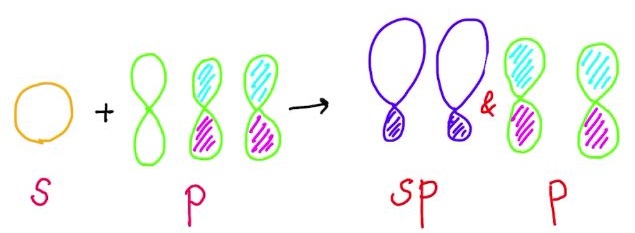
この未使用のp軌道は,先ほどのsp2混成軌道と同様に,π結合に使われます。
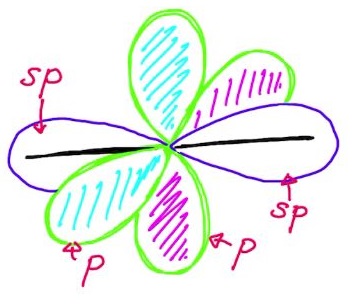

三重結合をもつアセチレン(C2H2)を例にして考えてみましょう。
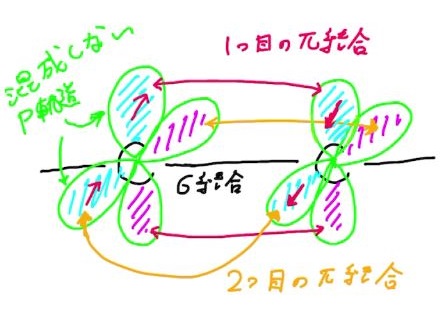

混成に未使用のp軌道がπ結合を二つ形成しているのがわかります。
つまり,アセチレン分子に見られる三重結合は
ひとつのσ結合 と ふたつのπ結合
からできています。
このσ結合はsp混成軌道同士の重なりの大きい結合の事です。また,sp混成軌道に参加しなかった未使用のp軌道が2つあります。それぞれが,横方向で重なりの弱い結合を形成します。
まとめとして
今回,新学習指導要領の改訂について論じてみました。
本記事は,
「炭素原子の電子配置の資料を示して,メタンが正四面体形である理由について,電子配置と構造を関連付けて」
に関係しています。
これまでの「化学基礎」「化学」では,原子軌道や分子軌道が単元としてありませんでした。そのため,暗記となる部分も多かったかと思います。今回の改定で「なぜそうなるのか?」にある程度の解を与えるものだと感じています。
また,メタンの正四面体構造を通して、σ結合やπ結合についても踏み込むと考えています。
分子模型があったほうが便利そうなのも伝わったかと思います。
売り切れる前にぜひ。
初等教育で学んできた内容の積み重ねが,研究で生きるときがあります。
それに出会ったとき,それはそれは,震えますよ(笑)

















[…] 混成軌道 → 高校生向け「混成軌道」 新課程対応 […]
[…] > (高校化学) 混成軌道のわかりやすい教え方を考察 ~メタンの立体構造を学… […]