周期表の第17族(右から2番目)に、F(フッ素),Cl(塩素),Br(臭素),I(ヨウ素),At(アスタチン),Ts(テネシン)は,ハロゲン(族)と呼ばれる。
ハロゲン自体は,単体で二原子分子(二つの原子で一つの分子になること;F2とかCl2とか)であり,有色・有毒の物質です。有毒とは言っても,

プールの塩素くさい。など聞いたことがあるかと思います。
人体に有毒なものは,ウィルス等についても有毒です。容量を守れば,人体にはほぼ無害でウィルスをやっつけることもできます。塩素でいえば,プールの塩素濃度は0.4mg/Lの遊離残留塩素濃度を保つように厚生労働省から指導されています。塩素を入れておかないと,すぐに「藻」でいっぱいになっちゃいます。
水道も塩素消毒(0.1mg/L以下)は行われているので,毎日水道水を使ってお風呂に入っているのですからプールの塩素も怖がる必要はありません。
知識をもって「正しく恐れる」ことが化学においては大事です。
なお、「塩素くさい」のは塩素の匂いではなくって,プールに入っている遊泳者の汗や尿などから発生するアンモニア成分と塩素(次亜塩素酸由来)が反応することで生成する「クロラミン」です。つまりは,遊泳者が水中で排尿しない限り,塩素臭と目や鼻などへの刺激も生じない・・・。この辺の統計については,Wikipediaの「プールの臭気や人体への影響について」が興味深いです。。。ある意味で。
さて、今回はハロゲン化水素(HF, HCl, HBr, HI)の性質について論じます。※ハロゲン化水素は「危険」なので,使う場合は自分自身で調べたうえで指導者の指示に従ってくださいね。
ハロゲン化水素の酸性度
HF < HCl < HBr < HI
ハロゲン化水素(HF, HCl, HBr, HI) の酸性度としては,フッ化水素(HF)が最も弱く,ヨウ化水素(HI)が最も強い酸と言えます。
ただ,フッ化水素の性質や電気陰性度を学んだ人を知っている人にとっては, ハロゲン化水素(HF, HCl, HBr, HI) の中で,フッ化水素が最も弱い酸であることに【違和感】があります。
フッ化水素の化学的性質
フッ化水素はケイ素(Si)と反応するために,いわゆるガラス製のフラスコを溶かしてしまいます。そのため、保存にはポリエチレンやテフロンのボトルが使われます。
フッ化水素の液体(あるいは蒸気)が皮膚につくと,重度の化学火傷を起こし皮膚がケロイド状になります。(マジで気を付けましょう。特にフッ化水素を廃液として捨てる際に,足などにかかる事故が堪えません・・・)
また,フッ化水素は皮膚につくと,体内に容易に浸透します。フッ化水素はカルシウムイオンと反応性が高いことから骨(Ca)が溶けます。さらには,血中のカルシウムイオンとも結合するために,血中カルシウム濃度が低下することによる心室細動を起こし死亡する可能性もあります。
フッ化水素の取扱いは,本気で注意です!

なお,歯科で虫歯予防として用いるフッ素化合物は,フッ化水素(HF)ではなくフッ化塩(フッ化ナトリウム)です。歯磨き粉の中にも含まれる成分で,歯の耐酸性を強化すると考えられています。
健康診断のバリウム検査で用いられるバリウムイオンも炭酸塩は殺鼠剤として使われるように猛毒ですが,硫酸バリウムは水に対する溶解度が非常に小さく,またX線を通さないためにレントゲンの造影剤として使われています。
元素はその形(化合物)によっては,我々の毒にもなるし健康を助ける役割も持つことをお忘れなく。
さらには、このフッ化水素は「コンピューターの頭脳である半導体」や核燃料製造には欠かせない試薬です。さらには、これらの半導体や核燃料の製造には【高純度】のフッ化水素が必要となります。この【高純度】のフッ化水素の製造量は,世界で見ると日本が80%,中国が20%であり,日本の戦略的な物資と言え,輸出についても厳しく統制されています。
フッ素原子の電気陰性度 (フッ素、最強!)
電気陰性度というのは,「分子内の原子が電子を引き付ける強さ」のことで,全元素中の中でフッ素原子が最も大きい電気陰性度を示します。
電気陰性度(Electronegativity)
Webelements Periodic Table
Electronegativity (Pauling)
周期表からも電気陰性度は「フッ素」を頂点として,第X周期(縦方向)が増えるにつれ,電気陰性度は下がり,族(横方向)番号が小さくなるにつれても電気陰性度は下がります。左下に弱くなり,右上に強くなるということです。
フッ素の電気陰性度が水素に対してあまりにも大きいために,フッ化水素分子間で二量体あるいは多量体を構成します。
さて,これを踏まえて酸性度の説明です。前述のとおり,フッ素最強のわりに、酸性度の順番は
HF < HCl < HBr < HI
です。では,酸性度について考えてみましょう。
身近なハロゲン化水素であるHCl(塩酸)を例とします。中学校でもつかう試薬で,「塩酸を貝殻(CaCO3)と反応させることで二酸化炭素を発生させて石灰石が白く濁る」みたいな実験もやったかと思います。酸性度というのは,【酸の強さ】を表していて,「水素イオン(H+)」の量が多いほど酸性度が高くなります。
HCl → H+ + Cl-
H+の量が多いということは、このイオンにわかれる反応が多く進むことを意味しています。
フッ化水素の化学的性質の「すごさ」はいったん忘れてもらって,フッ素原子の電子を引き付ける強さである電気陰性度を思い出してみましょう。電気を引き付ける力は,ハロゲン族の中でも一番強いです。つまり,フッ素原子は水素を強くひきつけています。上記のHClの説明で示したように,
「水素イオン(H+)」をあまり出さない。= 「水素イオン(H+)」 量が少ない。
>> ハロゲン族の中で酸性度が一番弱い。と考えることができます。
酸性度については,この電気陰性度の強い=水素との結合力の強い=水素量が少ない と考えることができるので,
電気陰性度の順番は,F > Cl >Br > I なので,酸性度は「 HF < HCl < HBr < HI 」と考えられます。
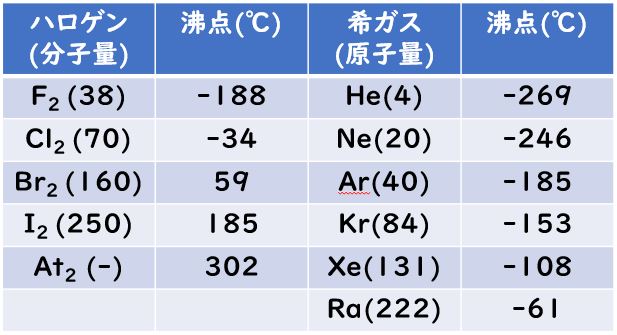
ハロゲン化水素の沸点
HCl(-85℃) < HBr(-67℃)< HI(-35℃) < HF (20℃)

フッ化水素をのぞいたハロゲン化水素のみっつ(HCl,HBr,HI)については分子量が大きくなることによる分子間のファンデルワールス力が大きくなるために,沸点は分子量の増加とともに大きくなります。
しかし,HFは分子量が小さいにも関わらず沸点が大きくなるのは,Fの電気陰性度が大きいため,F-H結合が強く分極することで,酸性度の時と同様に水素結合によりHFの多量体が生成されているために沸点が高くなります。また、周期表の周期性から【フッ化水素の沸点】が外れるので,テスト問題となりやすいのです。
なお,17族のハロゲン族について述べましたが,この【水素結合による沸点の周期性のズレ】は,16族と15族でも観測することができます。15族のNH3と16族のH2Oは分子量が同族の中で小さいにも関わらず,沸点は他の同族元素に比べて大きな値を示します。
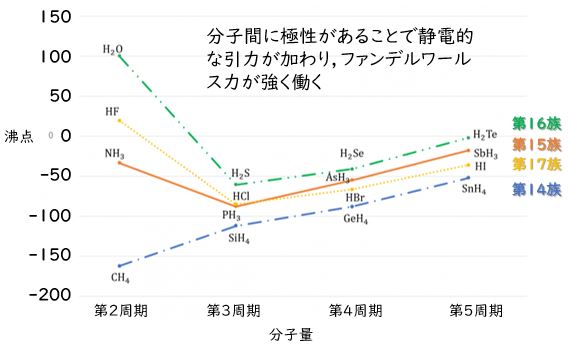
一方で,14族については,分子量の増大に伴って【順番に】沸点が上昇しています。これは,分子量がもっとも小さいCH4(メタン)が無極性分子のために,分極による水素結合が形成しないためです。
無機化学・高校化学と中学理科
下記の記事も参考になれば!


![[YouTube動画]電子軌道と電子配置と周期表の成立ち](https://tomonolab.com/wp-content/uploads/2021/11/6034-000855-56a12ee85f9b58b7d0bcd9f8-5c759a244cedfd0001de0ad9-150x150.jpg)









コメントを書く