基礎化学から大学の無機化学までのYouTube動画を作成中です。
動画作成のキッカケとしては,配属学生さんが学外の大学院を志望するためです。また,当ラボは教員志望の学生さんも多いです。>> 当ラボの進学先・就職先
色々と習熟度を確認する過程で,無機化学辺りが「完全な暗記」となっていたので,暗記に頼らない無機化学の授業動画を公開するに至りました。
さらには,2022年4月より高校1年生を対象に年次進行で進む「新学習指導要領」でも大学での無機化学範囲が単元に含まれる可能性が大いにあります。>>関連記事は コチラ

当ラボの研究内容も無機化学系で
大学院試験と教採対策で
一石三鳥ぐらいになります。
ご笑覧いただければ幸いです。
本記事では,「原子」から始まり「電子殻」と「原子軌道」の関係を明らかにして,周期表の成立ちを理解する基礎化学をご紹介します。
無機化学動画のコンセプト
無機化学動画のコンセプトは「2点」です。
- 10分以内で納得する動画 (10分越えたらご愛敬)
- 高校化学でもわかるように基礎化学から無機化学へ発展 (高大接続)
教員志望の学生さんもいるので,高大接続も考慮して高校化学にも対応できるよう授業構成を考えました。
では,早速行ってみましょう。
【8分】原子と電子 #1
ボーアの原子模型を参考にして,原子核と電子の関係をおさらいします。
「そんなのもうわかってるよ!」
こんな当たり前のことでも、注意深く見ると規則性が変化することがわかります。
例えば,
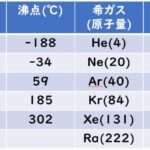
18番目のアルゴン(Ar)の質量数:39.95
19番目のカリウム(K)の質量数:39.10
原子番号が大きくなるのに,質量数は減少しています。
この理由は中性子の数が関係しています。そのため,あの同位体の存在比を考慮する計算式が重要担てくるのです。
【15分】電子軌道とエネルギー準位 #2
早速,10分オーバーしていますが,ご愛敬でお願いします。
新学習指導要領で追加されるであろう原子軌道(s軌道,p軌道,d軌道)を学びます。大学の基礎化学や無機化学では当然学ぶ単元です。
高等学校では,K殻やL殻等の【電子殻】を学んでいます。
この【電子殻】と【原子軌道】の関係を理解できる動画です。
この記事を読んでいる高校生からしてみると,「覚える単元が増えた」とネガティブに思う方もいるかもしれません。そんな心配無用です。
原子軌道を学ぶことで,これまで「暗記」するしかなかったことを理解できるようになります。
生徒の「なぜ?」に対して
教員が「これはこういうもの」から「これはね~」となるのだから素敵なことだと思います。
ですよね。先生。
【12分】電子の入れ方と電子配置 #3
#2の「電子軌道とエネルギー準位 #15分で納得」で,電子殻と原子軌道の関係を理解した後,次はそれぞれの軌道への「電子の入れ方」を学びます。
電子の入れ方には【3つのルール】があります。
- 構成原理:低いエネルギーから電子を入れる。
- フントの規則:電子を軌道に入れる場合は,別々の軌道に電子スピンがそろうようになるべく入れる。
- パウリの排他原理:ひとつの軌道には電子は2個まで収容できる。収容する際には,互いのスピンが反対になるように入れる。(アップスピンとダウンスピン)
このルールを適用することで,
原子の電子配置
がわかります。
この電子配置は基礎化学において,ちょくちょく出てくるので理解しておくことが必要です。VESPR則や分子軌道法においても,この電子配置を起点として授業が展開されます。
ここで,高校化学の長年の【謎】が明らかになります。
19番目のカリウム原子の「電子殻」の電子配置は以下の通りです。
19K:K2L8M8N1
M殻には18個の電子が入りますが,カリウムでは8個の電子が入って,N殻に電子が入ります。高校ではオクテット則で説明されていましたよね。
でもね
20Ca:K2L8M8N2
21Sc:K2L8M9N2
カルシウムまではいいですけど,スカンジウムになるとN殻はオクテット則でもないのにM殻に電子が入ります。(20番目まで原子を覚えさせられたのもこの辺りが原因なんじゃないかと疑っています。。)
どうゆうこと?
となりますよね。
この謎は,原子軌道と電子殻の関係がわかることにより理解できます。
【14分】周期表の成立ちと特殊な電子配置 #4
原子軌道と電子殻の関係がわかり,構成原理・フントの規則・パウリの排他原理により,電子の入り方を学んだあとは,周期表の成立ちです。
ここで,基礎化学の【超序盤】が終わりです。
周期表の成立ちを理解することで,周期表を「パッ」とみて原子の電子配置がわかるようになります。

これが大事
それから,特殊な電子配置を取る「d4」と「d9」について理解するのが流れです。
において,キーとなるのは【半閉殻】と【閉殻】です。
半閉殻と閉殻が安定になる理由は量子化学の出番ですので,それはまた別のお話し。
本記事は以上です。
Yotube授業動画一覧
無機化学 >> こちら
物理化学 >> こちら
機器分析 >> こちら
Youtubeはこちらから → YouTubeチャンネル「とものらぼ」



![[Youtube動画]応用化学コース 香西先生と鎌田先生の模擬授業動画](https://tomonolab.com/wp-content/uploads/2021/07/dom-fou-YRMWVcdyhmI-unsplash-150x150.jpg)













コメントを書く