始皇帝が不老不死を求めて服用した「水銀」に関するお話しです。
水銀を見たことある方は,あの液体金属は非常に魅力的であることはわかるかと思います(思いますよね?)。
ただ,水銀は液体自身および「蒸気」にも毒性があります。
水銀は,金を採掘する際に利用されていた(現在でも利用されており環境破壊につながっています)ことからも,かつての金山や銀山にも水銀中毒になりうる可能性が十分にあります。
立ち入り禁止区域には決して立ち入らないようにしましょうね。
さて,水銀が液体である理由の前に周期表の簡単なお話し。
水兵リーベ僕の船 名前あるシップスクラークか
スイ(水素; H)ヘイ(ヘリウム; He)リー(リチウム; Li)ベ(ベリリウム; Be)
ボ(ホウ素; B)ク(炭素; C)ノ(窒素; N, 酸素; O)フ(フッ素; F)ネ(ネオン; Ne)
ナ(ナトリウム; Na)マエ(マグネシウム; Mg)アル(アルミニウム; Al)
シッ(ケイ素; Si)プ(リン; P)ス(硫黄; S)
クラ(塩素; Cl)ー(アルゴン; Ar)ク(カリウム; K)カ(カルシウム; Ca)
周期表を覚えるための超絶有名な【語呂あわせ】ですね。
※ 語呂合わせなので,どうでも良いことかもしれませんが,私は「リーベ」はドイツ語の愛する(;Liebe)だと思っていたのですが,水兵さんの名前「リーベ」という説もあるんですね。(リーベさんって,誰?)
周期表

元素と言えば,やっぱり「世界で一番美しい元素図鑑」は一家に一冊あってよいおススメ本です。
各種元素について細かい小ネタを手に入れることもできますし、何よりも多くの写真が見る人を楽しませてくれます。
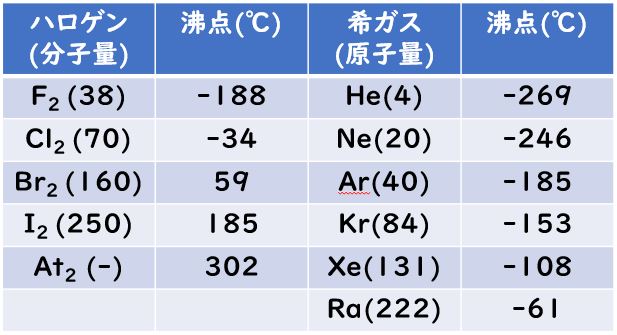
周期表と融点
さて、周期表は「性質の似ている元素」を並べた表として知られています。そのため,各種物性について周期表をながめると,まさに「周期的」な性質を見ることができます。
周期的な性質で並べているから周期表と言います
▼
例えば、今回お話しする「水銀が液体である理由」に関係する【融点】で周期表を眺めてみるとある法則性が見つかります。
周期表と合わせて,融点を見てみると
- 金属元素の中で,12族 (Zn, Cd, Hg)に【谷】がある。
- 大体4~11族をのぞいて,周期が大きくなるほど融点が下がる。
- 遷移金属元素では,6族のW(タングステン)の融点が最も高いです。フィラメント(; W)は白熱電球のフィラメントとして使われています。
※エジソンが発明した白熱電球についても面白い話がありますが、これはまた別のお話し。
融点と原子半径と結合力の関係
融点とは,固体が液体になり始めるときの温度です。
温度を上げていくにつれて,固体から液体になるときの温度ですね。水で言うと「0℃」が融点です。
温度が高くなるにつ入れて,原子の振動が活発になります。
固体状態の原子は整然と並んでいますが,温度が上がるにつれて原子の振動が大きくなり,整然と並べずに,バラバラになります。
このバラバラの状態が液体になり始めているといえるでしょう。
原子同士を整然と並ばせておく結合力として考えると,温度が高くなるにつれて,結合を部分的にも切断して動き始める原子がいるために、整然と並ぶことができなくなります。
つまり,「結合力が高い」ということは,原子を整然と並ばせておける力が強い=固体状態として維持できる力が強いということを意味しています。
よって,「結合力が強い」=「固体状態として維持」=「融点(固体から液体になるときの温度)が高い」ことを意味しています。
1族のアルカリ金属では周期が大きく(周期表の下方向)に行くにつれて、融点が下がります。
Li(180.5℃),Na(97.79℃),K(63.5℃), Rb(39.3℃),Cs(28.44℃),Fr(27℃)などなど。
これは,周期が大きくなるにつれて「原子半径が大きくなるため」に,結合力が弱くなるために,融点が下がります。
※アルカリ金属の1原子当たりの自由電子の数はどれも1個で等しいですが,原子半径が大きくなることで,単位体積当たりの結合に関与する電子数が相対的に少なくなるために,結合が弱くなり、融点が下がります。
水銀が液体である理由
っと、ここまで書いてきて,軌道の話をしていないと説明が長くなることに気が付きました・・・。軌道についてはまた別のお話し。
さて,水銀の融点が低い理由は,先の原子半径と結合力の関係に加えて,その電子構造にあります。
水銀の電子構造:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5d10 6s2
f軌道は遮へい効果が低く,核の最外殻電子(6s軌道の電子)へ与える有効核電荷が高くなります。
さらに,4f軌道と5d軌道の電子が最大個数の電子が収容されています。つまり, 最外殻電子(6s軌道の電子) の有効核電荷(電子が核から実際に感じる電荷の大きさ)が非常に大きくなります。
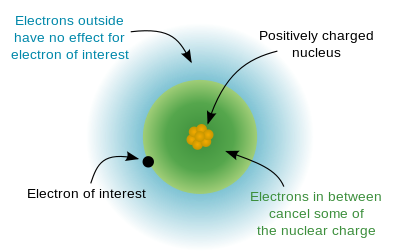
有効核電荷が大きいということは,核が電子を引っ張る力が強いということです。
水銀の最外殻電子の電子は核に強くひきつけられており,自由電子(結合に関与する電子)として機能しづらくなります。(不活性電子対効果のひとつ)
- 原子半径が大きいため,単位体積当たりの結合に関与する自由電子が少ないために,融点が低くなる。
- 有効核電荷が大きいため,結合に関与する最外殻電子が核に強く引きつけられており,水銀原子間(HgーHg)の結合が弱くなる。
この理由により,水銀は常温で「液体」として存在します。














ご説明ありがとうございました。
>さらに,4f軌道と5d軌道の電子が最大個数の電子が収容されています。→つまり, 最外殻電子(6s軌道の電子) の有効核電荷(電子が核から実際に感じる電荷の大きさ)が非常に大きくなります。
「つまり」のつなぎが分かりにくいと思いました。
4f軌道と5d軌道の電子が最大個数の電子が収容されていたら,いくら遮蔽効果が弱くても負電荷が増えることで遮蔽効果は高まるはずです。
4f軌道と5d軌道の電子が最大個数の電子が収容されている,つまり原子番号が増えていて陽子の正電荷が増えているが,4f軌道と5d軌道の遮蔽効果が弱く正電荷の増分を打ち消すほどではないから6s軌道の電子におよぶ有効核電荷が増える(ゆえに束縛強く,6s電子は結合に関与できない)と解釈しましたが正しいでしょうか?