原子の大きさ
原子の大きさとは何でしょうか?
軌道を学んでいるのであれば,すべての電子軌道には明確な境界はなく,無限遠まで薄く広がっています。そのため,原子半径も成果な値で決まるわけではありませんし,同じ原子でも,結合する相手や結合条件などによって少し変化します。
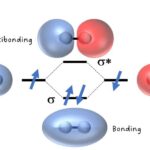
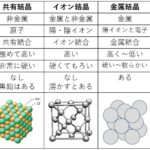
原子やイオンを結び付けている化学結合には,共有結合,イオン結合,金属結合がある。また,分子(あるいは原子)間の相互作用として,水素結合とファンデルワールス力があります。

その結合力の大きさは以下の順番通りである。
共有結合>イオン結合,金属結合>水素結合>ファンデルワールス力
さて,【実は!】,これらの結合の種類に応じて、原子の「半径」にはいくつかの種類があります。
共有結合半径
共有結合半径とは,原子同士が【共有結合】している二原子間の距離の半分を表します。ここで大事なのは原子同士が【結合】していることと,共有している電子は隣接原子のみ。ということ。多重結合をのぞく単結合で形成される電気陰性度が同じである同じ原子による二原子分子の「原子間距離の2分の1」が共有結合距離と定義されています。
イオン半径
イオン半径は,原子がイオンとして【結合】しているイオン性化合物中の各種イオンを剛球体と仮定したときに割り当てられる半径のことです。この半径の場合,【イオン】と名称がついているだけあって,その原子の酸化状態や隣接原子の種類によって値が異なってくるのが特徴です。この値によって,そのイオンの性質などを反映しているとも言えます。つまりは、「このぐらいの半径だったから,酸化数は+Xだと推察されます」みたいな。
例えば,
正電荷の場合,電子を失って【イオン】となっていますので,元の原子より小さい値になります。さらに,詳しくは電子が引き抜かれることで,電子間の反発が減ることで,原子核の有効核電荷が増えるために,核が周囲の電子をよりひきつけます。つまり,単純に,外側の電子がいなくなる以上に,サイズが小さくなります。
負電荷は正電荷と全く逆です。電子を加えて【イオン】となりますので,元の原子より大きい値になります。これも,電子が加わることで最外殻電子間の反発が増えるために,遮蔽効果が大きくなり,結果として有効核電荷が減少します。このため,最外殻電子への引力が減るので,負電荷は,元の原子より大きくなります。
※有効核電荷=核に引っ張られる強さ のこと。
金属結合半径
共有結合と同じ考えであるが,原子同士が【金属結合】しているときの金属間距離の半分の距離が金属結合半径という。共有結合と違うのは,電子は塊全体で電子を共有(自由電子)しています。
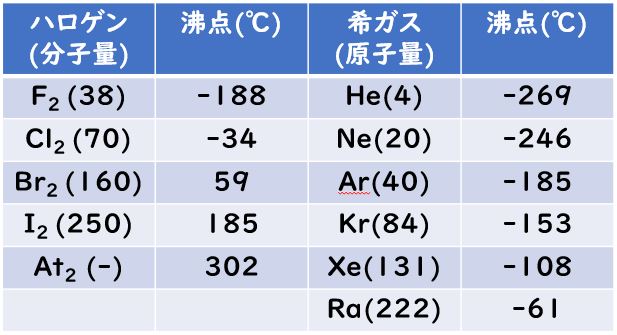
ファンデルワールス半径

ヨハネス・ディーデリク・ファン・デル・ワールス
気体の状態方程式(PV=nRT)でノーベル賞を受賞しました。
さて,分子間力であるファンデルワールス力なので,ファンデルワールス半径は【結合を形成していない】原子同士が近づける距離のことです。原子同士が結合することなく,ピタッと接しているときの距離のことです。
ということなので,ファンデルワールス半径は,原子の一番外側=最外殻電子数の広がりで決まることが予想できます。最外殻電子が大きいものがファンデルワールス半径が大きく,最外殻電子が小さいものがファンデルワールス半径が小さいと予想できるはずです!












コメントを書く