さて,大学の無機化学と言えば「分子軌道論」ではないでしょうか(個人的感想)。
この明快な論は,高校受験の暗記ばかりの無機化学分野の印象を払拭します。
受験生の訪問者は,ぜひ大学での無機化学を楽しんでください。
分子軌道論
前回までに,原子価結合法(VB法)および混成軌道(法)を解説してきました。
原子のもつ原子軌道(Atomic orbital)の波動関数を解くことによって,s軌道やp軌道などの波動関数の形と電子の存在領域の形が似ていることが分かったかと思います。
今回は,それら原子軌道間の結合による分子軌道についてです。
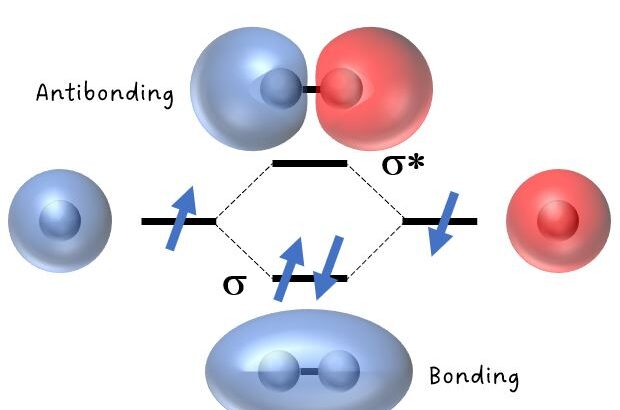
なお,各原子軌道(波動関数)は,波と同様に,正負の振幅をもち,正同士(あるいは負同士)であれば強め合います。一方で,振幅が「逆位相」の場合は弱め合います。
この同位相および逆位相による軌道の「重なり」を意識すると理解が早いです。
※なお,この軌道の重なりを「重なり積分」とも言ったりします。
分子軌道と結合次数
【無機化学 18 】分子軌道法と結合次数 「30分で納得」
水素分子(H2)やLi分子(Li2)を例にして,分子軌道法を説明しています。
結合次数は簡単ですが,重要ですしテストに出やすいので確実に理解しましょう。
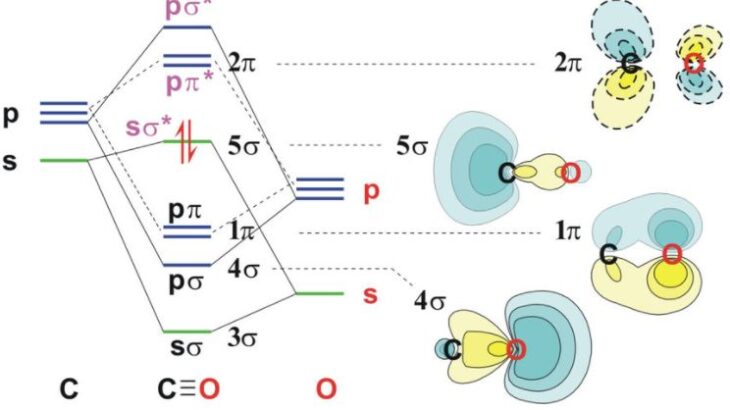
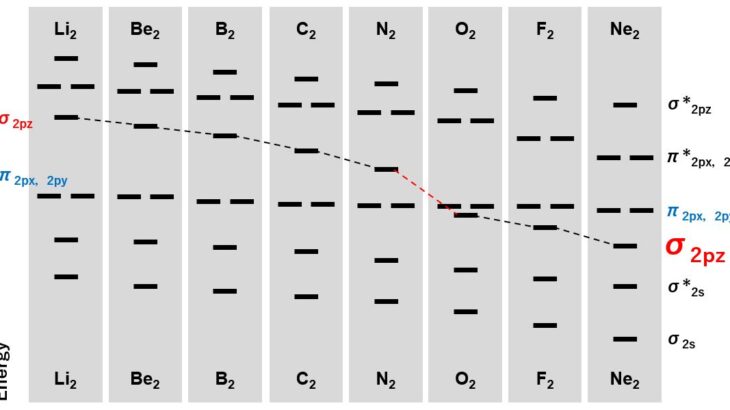
また,p軌道によって,エネルギーが低いσ結合とエネルギーが比較的高いπ結合ができることも学びます。
なお,後半では分子軌道法ではあまり気にしてくれない基本的なことについても論じています。
- 有効核電荷との関係;1sより2sの方が,エネルギー分裂が大きくなります。
- 1sと2sは分子軌道を形成しない。エネルギー差が十分に大きい場合,分子軌道を形成しません
この1と2が,等核二原子分子や異核二原子分子の分裂を考える上でも重要になってきます。
YouTube「とものらぼ」一覧
無機化学 >> こちら
物理化学 >> こちら
機器分析 >> こちら
Youtubeはこちらから → YouTubeチャンネル「とものらぼ」





![[YouTube動画]電子軌道と電子配置と周期表の成立ち](https://tomonolab.com/wp-content/uploads/2021/11/6034-000855-56a12ee85f9b58b7d0bcd9f8-5c759a244cedfd0001de0ad9-150x150.jpg)






[…] ブログ → 分子軌道法と結合次数 (要点をまとめました) […]
[…] 前回の記事で,分子軌道法の導入を行いました。 […]