原子同士が結合して分子を形成する際の「結合」には様々な考え方が生まれています。
今回は,原子価結合法(VB法)の紹介です。
原子価結合法(Valence bond theory)
結合について,学んだことのある学生さんは,「分子軌道法 (MO法) ・・・・」と思う方が多いですよね。分子軌道と混成軌道は・・・といった感じかと思います。
ざっくり年代も被るのですが,
説明しますと
原子価結合法: G・N・ルイス 19-16年~1927年成立
分子軌道法:フリードリッヒ・フント、ロバート・マリケン、ジョン・クラーク・スレイター、ジョン・レナード-ジョーンズ 1927年~1933年成立
混成軌道(法): ライナス・ポーリング 1931年 >> 原著はコチラ
の順序で発展してきました。
そのため,それぞれの導入部分(すべてが深く学ぶと深い)においては,原子価結合法の方が単純であり,年代が進むにつれて複雑です。複雑と言っても,発展と共に課題を解決し行った感じでしょうか。
つまり,比較するとこんな感じに分類できます。

ここからわかるのは,
原子価結合法の方が直感的でわかりやすい反面,説明できない分子が出てきます。
原子軌道 と 結合による分子結合
2022年度の新学習指導要領から,原子軌道は,高校より学び始めます。
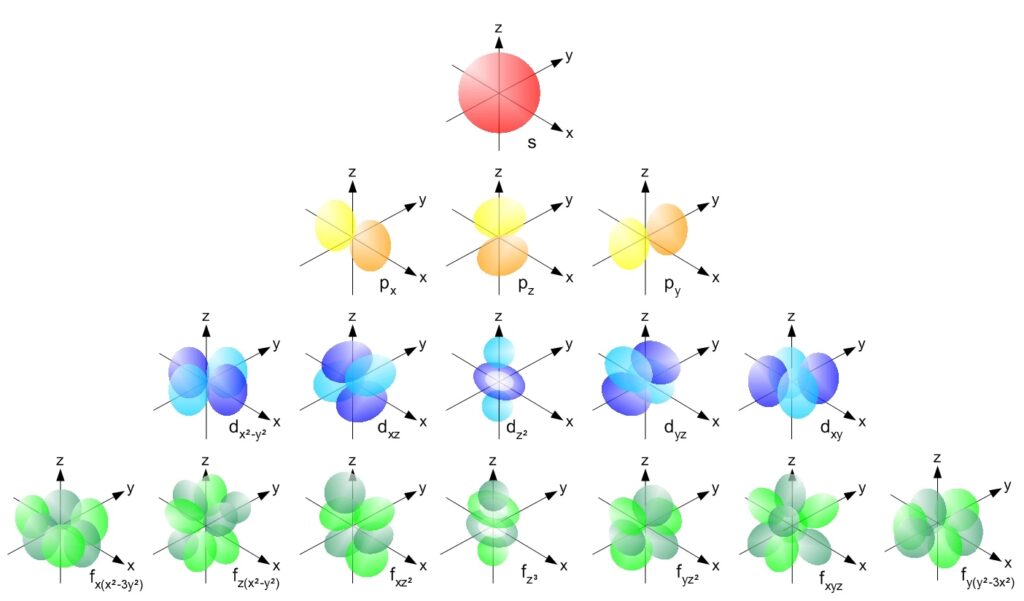
上記にはs軌道,p軌道,d軌道,f軌道の形状を表しています。 出典はコチラ(chemwiki)
下にいくほど,軌道の種類は増えますし,その形状は複雑になっていることがわかるかと思います。
突然,ギリシャ文字の説明になりますが,
ギリシャ文字(α,β,γから始まる文字)は,アルファベットと同様に26文字あります。ギリシャ文字とアルファベットが対応しています。
19番目のアルファベット s → 19番目のギリシャ文字 σ (シグマ)
16番目のアルファベット p → 16番目のギリシャ文字 π (パイ)
4番目のアルファベット d → 4番目のギリシャ文字 δ (デルタ)
f軌道だけが違うんですが,f軌道間によって形成されるφ結合(ファイ)は,結合軸方向から見た軌道対称性が通常の(6つの葉型)f軌道と同じであることからの命名です。
原子結合同士で形成される共有結合
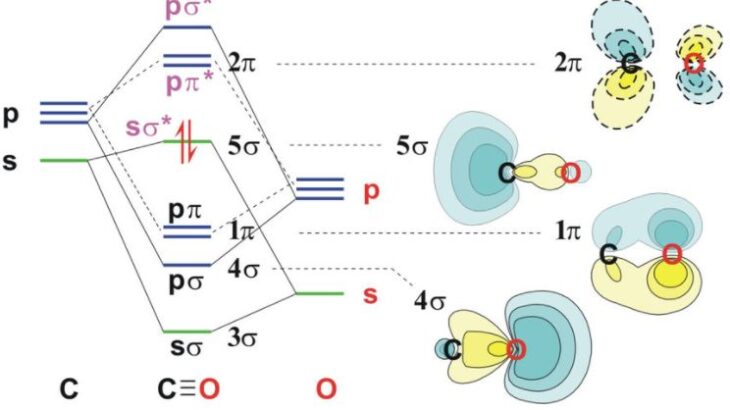
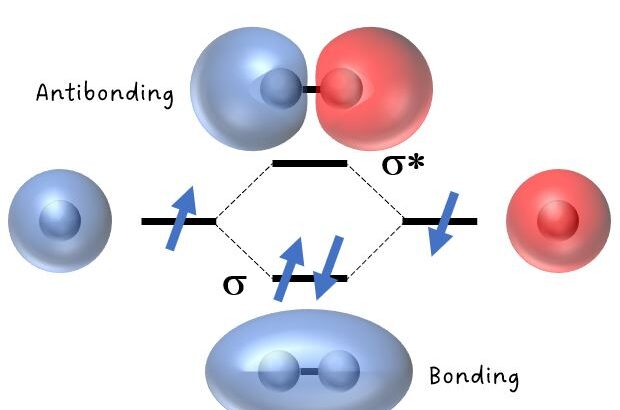
先に説明したように,原子間で形成される結合にはσ結合やらπ結合という名称がついた結合があります。
これらは,ふたつのs軌道間の「重なりが大きい」結合の事を,σ結合と言います。
一方で,p軌道にはx軸に伸びるpx軌道,y軸に伸びるpy軌道,z軸に伸びるpz軌道があります。
今、z軸上に「ふたつの原子」があると仮定すると
z軸上で二つの原子が近づくことで結合が形成される場合,p軌道の伸びる方向で,結合の重なる大きさに差が生じます。
重なりが大きい方を,σ結合
重なりが小さい方を,π結合 と呼びます。
つまり,p軌道からは,ひとつのσ結合とふたつのπ結合が形成されます。
これについては,下記のYouTube動画が理解の助けになります。
原子価結合法(VB法)と共有結合の名称 「9分で納得
原子価結合法に関する関連動画
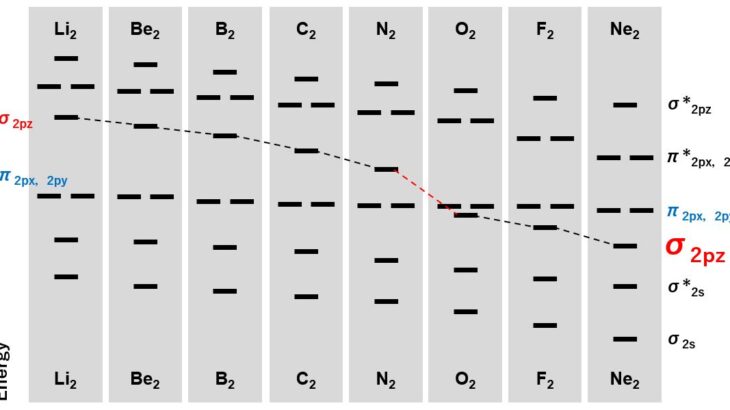
分子軌道法
ブログ → 分子軌道法と結合次数 (要点をまとめました)
Youtube動画はコチラ
混成軌道
ブログ→ 高校生向け「混成軌道」 新課程対応
Youtube動画はコチラ
YouTube「とものラボ」一覧
無機化学 >> こちら
物理化学 >> こちら
機器分析 >> こちら
Youtubeはこちらから → YouTubeチャンネル「とものらぼ」




![[YouTube動画]電子軌道と電子配置と周期表の成立ち](https://tomonolab.com/wp-content/uploads/2021/11/6034-000855-56a12ee85f9b58b7d0bcd9f8-5c759a244cedfd0001de0ad9-150x150.jpg)
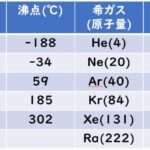

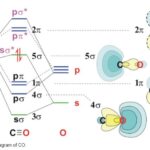
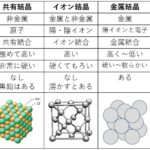





[…] 前回までに,原子価結合法(VB法)および混成軌道(法)を解説してきました。 […]