さて,高校化学で学ぶ「共鳴構造」。結構,わからない人がいます。
HGS分子模型を使ってあげれば,すぐにわかります。
わからない原因としては,二重結合が「σ(シグマ)結合×1とπ(パイ)結合×1」からできているという理解ができていないからです。
シグマ結合とパイ結合の復習
シグマ結合やパイ結合は,混成軌道の単元でも学ぶかと思います。混成軌道の記事はコチラ
以下のHGS分子模型は,二重結合をひとつもつエチレン(CH2=CH2)です。

三重結合をひとつもつアセチレン(CH≡CH)は,以下の模型です。

これらの図を用いて,丁寧に説明していこうかと思います。
シグマ結合とパイ結合の「分子模型」による理解
HGS分子模型は,大学の有機化学で初めて使いましたが,その当時も「π結合の羽」を間違えて解釈している友人が多くいたのを覚えています。
どのように間違えていたかというと・・・

黒い球:炭素,白い球:水素
炭素から、2本のCH結合(ピンク)が出ています。
さらには,白い結合が「σ(シグマ)結合」です。
そして,青い羽と緑の羽で「ひとつのp軌道」です。
「青い羽が ひとつでp軌道」では,ありません。間違えています。
さて,「青い羽」「緑の羽」がひとつづつのp軌道と勘違いすると,上記のエチレンのHGS分子模型は,ひとつのシグマ結合と ふたつのパイ結合 と考えるので,アセチレンと勘違いします。(※水素2個ついてるのに涙)
「青い羽と緑の羽で ひとつのp軌道」です。
それぞれの炭素から,それぞれ「ひとつのp軌道(青い羽と緑の羽で1対)」がでていて,それが横方向で相互作用することにより「π(パイ)結合」を形成しています。
炭素(黒い球)からは,「白い棒」である「ひとつのσ(シグマ)結合」と「p軌道(青い羽と緑の羽)が横方向で相互作用」している「ひとつのπ(パイ)結合」によって,二重結合を形成しています。
では
上記のアセチレンで復習してみましょう。

灰色の球が炭素です。
炭素からは,
「白い棒」である「ひとつのσ(シグマ)結合」
「p軌道(青い羽と緑の羽)が横方向で相互作用」している「ふたつのπ(パイ)結合」
三重結合を形成
HGS分子模型による「多重結合の表現」がわかったかと思います。
共鳴構造の考え方と書き方
共鳴構造とは,有機化学反応で用いる記述方法です。本来ひとつの構造式として書き表せない状態を複数の構造を使って表すものです。
共鳴構造の代表例として,ベンゼン環と硝酸イオンがあります。
これを例にして,共鳴構造に慣れていこうかと思います。
ベンゼン環 (例:トルエン)
ベンゼン環は下記のように二重結合と単結合が交互に繰り返される構造式(ケクレ構造式)で書けますが,2つのケクレ構造式の「共鳴」として表されます。
左右で二重結合の位置が違ってますよね。結合の位置は違いますが,この二つの構造は同じものです。こういった,本来ひとつの高図式として書き表せないものを共鳴構造と言います。
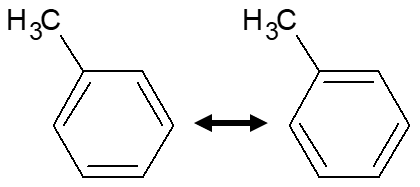
本当のベンゼン環では,単結合と二重結合の区別はなく,等価な結合(1.5重結合)であることがわかっています。下記のように,共鳴混成体と言う名称の書き方もあります。
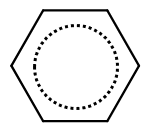
では,原点に立ち返りまして
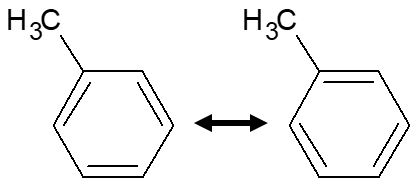
単結合と二重結合の位置が違うのに,なぜ同じものなのか?
HGS分子模型を使えば,すぐにわかります。
下記には,ベンゼン環のHGS分子模型を示します。
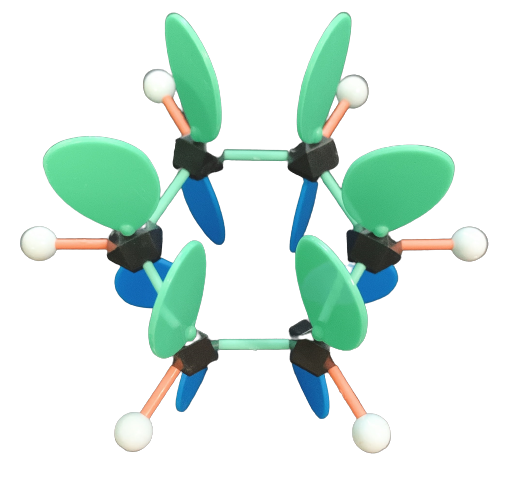
黒球:炭素 白球:水素
黒球間をつなぐ「緑の棒」がシグマ結合
黒球から出ている青い羽と緑の羽が「ひとつのp軌道」です。
p軌道は,横方向で相互作用することで,π結合を形成します。
試しに,任意にπ結合を作ってみます。
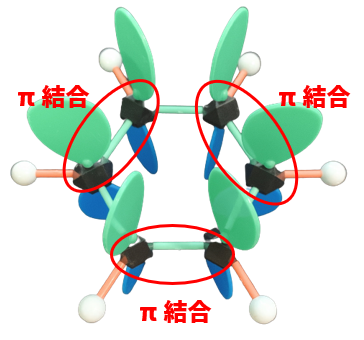
このようにπ結合を選んだ場合の構造式は,以下のようになります。
一方で,同じHGS分子模型でもπ結合の取り方を変えてみると
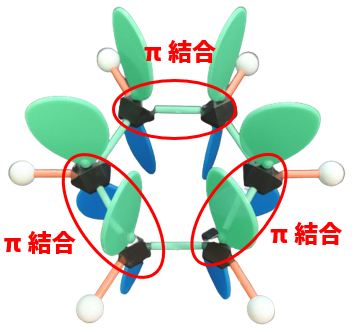
となりますよね。
もうお分かりかと思いますが,HGS分子模型は変わっていないのに,π結合の取り方によって,構造式中の二重結合と単結合のある位置が変わってきています。
結合位置が違っても,もともとの分子模型が一緒ということは,構造式が違っていても同じ化合物であることを示しています。
共役二重結合
共鳴構造と似た音の名称に「共役」があります。
この共役とは,化合物中に交互に位置する単結合および多重結合を持つp軌道のことです。共鳴構造で,単結合になったり二重結合になったりする結合のたまたま「二重結合」で示している部分を共役二重結合と言います。
上記のベンゼン環の共鳴構造で解説した「二重結合」はすべて「共役二重結合」と言えます。
硝酸イオンの共鳴構造
硝酸イオン(NO32-)は 三つの共鳴構造をもちます。
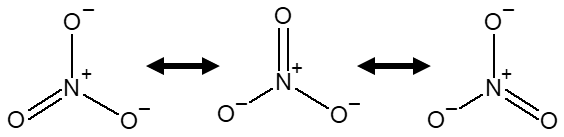
この三つの共鳴構造は,二重結合の位置が異なっていますが,同じ分子です。
HGS分子模型で表すと以下のようになります。

中央の青い球:窒素
周囲の灰色の球:炭素
シグマ結合は白い棒
青い羽と緑の羽でひとつのp軌道
このHGS分子模型において,中央の窒素原子が持つp軌道と,どの炭素がπ結合を形成するかで三種類の構造式を書くことができるということです。
YouTube動画の紹介
上記内容をYouTube動画として公開しています。
切り口も違いますので理解が深まるかと思います。
他の動画はコチラ
HGS分子模型の紹介
上記,解説に用いたHGS分子模型をご紹介します。大学の有機化学では,この模型があると理解の助けになること間違いありません。
個人的には,p軌道を「羽」で表すことができるシリーズがわかりやすいと思います。
実際に手を動かして,眺めて考えることで知識の定着が上がるかと思います。














コメントを書く