さて,前回の記事で「電子軌道と電子配置」の授業動画について紹介しました。教科書に載っている「周期表」はメンデレーエフではなく,ベルナーの周期表です。知ってました?
酸と塩基は,対になって働く物質です。高等学校までに「イオン(H+とOH–)や電子のやり取り」で,酸と塩基が定義されています。
今回は,これまで定義された【4種類+α】の違い(問題点からの改善点)を投稿します。
4種類の酸と塩基の違いを理解するには,「電子とイオンの科学史」を学ぶことが手っ取り早い
イオンと電子の科学史
イオンと電子が発見に至るまでの,科学者たちの議論や実験の歴史は非常に長いです。個人的には,このストーリーは「渾渾沌沌(こんこんとんとん)」としており,研究者として学ぶ意義が高い科学史です。
これらの科学史は,授業の合間に生徒の集中力を促すための「ネタ」として最適だと考えています。
身近なものの科学史って,「へぇ~」と思うことが多いですよね。
▼
さて,イオンと電子の科学史です。歴史を通して背景を学ぶことで知識の定着が促されます。本日は「酸と塩基」が主題なので「科学史はサラッ」と説明しますね。
イオンの歴史
イオンと言えば、この人!

マイケル・ファラデー(英: Michael Faraday、1791年9月22日 – 1867年8月25日)は、イギリスの化学者・物理学者
ファラデーさんと言えば,多くの日本人のノーベル賞科学者に影響を与えた著書「ロウソクの科学」が有名ですよね。
天才イケメン科学者のファラデーこと,マイケルファラデーさんが「1833年」に【(ファラデーの)電気分解の法則】を発見しました。
▼

電解質溶液中(イオンが溶け込んだ水)の電気分解により物質が分解して得られることを発見しました。
この時,【電子】の存在はまだ明らかではありません。
この結果を踏まえて,ファラデーは【電子】の存在が強く示唆される法則(第二法則)を提唱しています。
▼
この発表の際に,「アノード」「カソード」「イオン」「電極」などの用語の定着もさせています。元々の言葉を考えたのは「科学者」という言葉も作った「ウィリアム・ヒューウェル」です。
ファラデーは, 電気分解 によって「イオン」が生み出されると考えていた。
一方、「スヴァンテ・アレニウス」は電流を流していない状態でも水溶液中にはイオンが存在すると考えていました。アレニウスは水溶液中では「塩が解離して荷電粒子になるのでは?」と考えていました。つまり,アレニウスは水溶液中の化学反応はイオン同士の反応と考えていたということです。
※ポイント※ つまり,電子よりイオンの方が先に多くの科学者に受け入れられています。
電子の歴史
電子と言えば「量子論」が絡んできます。「量子論の確立までの科学史」も面白いので,今後まとめようかと考えています。
電子は,粒子かー波かー粒子なのか!!の紆余曲折が面白いところです。
※電子は,粒子でもあり波でもあります。
サー・ジョゼフ・ジョン・トムソン(Sir Joseph John Thomson, 1856年12月18日-1940年8月30日)は、イギリスの物理学者。
J・J・トムソンと称される電子の発見に大きく貢献した人物です。例えば,ゼーマン分裂でも有名なピーター・ゼーマンや地震学で有名なエミール・ヴィーヘルトも「電子の存在」について報告している。
トムソンの「陰極線の特性実験」において,原子に【電子】が存在することを「1897年」に報告しています。
陰極線管と言えば,ブラウン管TVですね。
▼

科学博物館等で見ることができる「プラズマボール」には希ガスなどの気体が封入されていますので,陰極線管とは厳密には違いますね。
それにしても,プラズマボールって2000円ぐらいで買えるんですよね。
さて,
科学史的には
- 「1833年」にイオンの存在
- 「1897年」に電子の存在
が確認されています。
酸と塩基の単元でも,科学的な理解が【イオン】から始まって【電子】に進みます。
つまり,酸と塩基の定義は,イオンから始まり電子に展開します
塩基とアルカリの違い
小学生の教科書にも掲載されている「アルカリ」は,正確には「塩基」とは同じ意味ではありません。
塩基の中にアルカリがあるので,アルカリの方が狭い概念です。
塩基は,酸と反応するものです。
アルカリは,塩基が水に溶けたものを示します。
例えば,アンモニア水は「塩基」であり「アルカリ」ですが,アンモニアは「塩基」であって「アルカリ」ではありません。
アンモニアは水に溶けていないですから,アルカリではありませんね。
YouTube動画の紹介
下記のメジャーな定義である「アレニウスの定義」「ブレンステッド・ローリーの定義」「ルイスの定義」をまとめた授業動画をアップロードしています。
ぜひ、ご視聴ください。
定義1 アレニウスの酸と塩基
【アレニウスの酸】とは,「水溶液中」で水素イオン(H+)を放出する化合物のことです。
例えば,塩酸(HCl),硫酸(H2SO4),硝酸(HNO3),酢酸(CH3COOH)があります。生成した水素イオンは,水溶液中で水分子と結合してオキソニウムイオン(H3O+)として存在します。
【アレニウスの塩基】とは,「水溶液中」で水酸化物イオン(OH-)を放出する化合物のことです。例えば,水酸化ナトリウム(NaOH),水酸化カリウム(KOH),水酸化カルシウム(CaOH),アンモニア(NH3)があります。
※ポイント※ 科学史のとおり,イオンを使った酸と塩基から始まります。
※ポイント※アレニウスの定義では,必ず【水】が反応に関与してきます。そのため,「水溶液中」での酸と塩基の定義であり,「水溶液」に限定されていることも注目ポイントです。
アレニウスの定義の問題点
- アンモニア(NH3)は,分子内に「水酸化物イオン(OH-)」をもっていません。アンモニアを水溶液中に溶かすことで,アンモニア(NH3)と水(H2O)からアンモニウムイオン(NH4+)と水酸化物イオン(OH-)が出ると解釈していますが,無理があるんじゃない?という問題点
- 「水溶液中」と定義しています。そのため,水以外の溶媒では酸と塩基を定義できない。アンモニアは塩基と定義できません。
- 難溶な塩基化合物である水酸化鉄(Fe(OH)3)等が塩基性を示すことを説明できない。
これらの問題点を改善するために,ブレンステッドとローリーによる酸塩基の定義が提唱されます。
定義2 ブレンステッドとローリーの酸と塩基の定義
【ブレンステッド・ローリー酸】とは,水素イオン(H+)を与える(ドナー)ことのできる混合物である。
【ブレンステッド・ローリーの塩基】とは, 水素イオン(H+)を受け取る(アクセプター)ことのできる混合物である。
「アレニウスの酸と塩基」とは違って,水素イオンの授受を軸とした相対的な定義と考えられます。
また,「水溶液」と限定していないため,アレニウスの定義で問題点であった(1)(2)を解消できます。
【例1】酢酸と硫酸について
弱酸である酢酸を溶媒として,硫酸を溶かすと以下の反応が進行します。
CH3COOH + H2SO4 → CH3COOH2 + HSO4–
この反応は,水以外の溶媒である酢酸中での酸塩基反応です。
また,水素イオンの放出(アクセプター)と受取(ドナー)を考慮すると,酢酸は水素イオンを受け取っているので「(ブレンステッド・ローリーの)塩基」であり,硫酸は水素を放出しているので「 (ブレンステッド・ローリーの) 酸」とみなすことができます。
【例2】 水とアンモニアの反応について
アレニウスの定義では,水酸化物イオン(OHー)を放出することで「塩基」です。しかし,塩基であるアンモニアは,自身の分子構造に水酸化物イオンを持っておらず,「モヤッ」としました。
ブレンステッドローリーで考えると解消されます。
NH3 + H2O → NH4+ + OH–
水から水素イオンを受け取るアンモニアは 「(ブレンステッド・ローリーの)塩基」 であり,水素イオンを放出する水は 「 (ブレンステッド・ローリーの) 酸」 とみなすことができます。
水素の授受による酸塩基の定義は,様々な化合物に適用することができます。
このように,アレニウスの「水溶液中」という考えを,溶媒(気体及び固体)中での【水素イオンの授受】による議論へと拡張しました。
ブレンステッド・ローリーの問題点
アレニウスの定義に比べて,その適用範囲も広く「アンモニア」などの分子内に水酸化物イオンを含まない化合物についても酸と塩基を定義できました。
しかし,下記の問題点があります。
- 「水素イオン」を含まない化合物の定義ができない。
さらに適用範囲を広げるべく概念を拡張したものが「ルイスの酸と塩基」です。
定義3 ルイスの酸と塩基の定義
※ポイント※ 「ブレンステッド・ローリー」と「ルイス」では,【授受】の関係が反対になります。
だってね。
ブレンステッドローリーは,【水素イオン(正電荷)】のやり取りです。
ルイスは【電子対(負電荷)】のやり取りです。
正負が【逆】ですからね
だからこそ,ここが大学での基礎化学のテスト問題になったりもしますよね。
ブレンステッド・ローリーの定義は,
【ブレンステッド・ローリー酸】とは,水素イオン(H+)を与える(ドナー)ことのできる混合物である。
【ブレンステッド・ローリーの塩基】とは, 水素イオン(H+)を受け取る(アクセプター)ことのできる混合物である。
ルイスの定義は
【ルイスの酸】とは,電子対を受け取る(アクセプター)ことができる化合物である。
【ルイスの塩基】とは, 電子対を与える(ドナー)ことのできる化合物である。
逆でしょ!
【ブレンステッドの酸】は,水素イオン(プラス)を与える化合物です。
一方で,【ルイスの酸】は,電子対(マイナス)を受け取る化合物です。
プラスマイナスが違うので,授受が反対の表現になるのもうなずけるかと思います。
【例1】水酸化物イオンと水素イオンの反応
H+ + :OHー → H:OH
電子対を供与するOHが「ルイスの塩基」であり,電子対を受け取るHが「ルイスの酸」です。
また,ブレンステッド・ローリーでは説明できなかった「H+」や「OHー」が含まれていない反応にも,酸塩基を定義できます。
例として,頻出する問題が「三フッ化ホウ素(BF3)」です。
【例2】BF3 と ジエチルエーテル(CH3CH2OCH2CH3)の反応
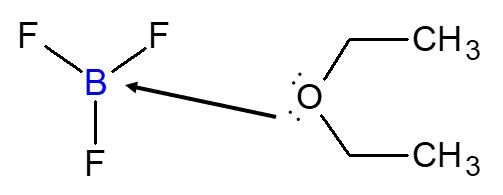
ジエチルエーテルの酸素がもつ非共有電子対が供与されるので,ジエチルエーテルが「ルイスの塩基」です。
三フッ化ホウ素が「ルイスの酸」となります。
無機化学の金属錯体への「応用」展開
また,金属イオンと配位子による金属錯体の場合,中心の金属イオンは配位子からの電子対を供与しているので,「ルイスの酸」です。
配位子は「ルイスの塩基」とみなすことができます。
このルイス酸とルイス塩基の強弱が「HSAB理論」へとつながってきますので,大学化学では「ブレンステッドローリーの酸と塩基」から「ルイスの酸と塩基」の説明に入り,「HSAB理論」へと説明が展開されます。
有機化学の求電子・求核試薬への「応用」展開
「ルイスの酸」は電子対を受け取る化合物です。つまり,有機化学で言うと「求電子試薬」です。
当然,「ルイスの塩基」は電子対を与える化合物=電子対を与える先を求める化合物ですので,「求核試薬」です。
大学の有機化学においても,ルイス酸と塩基から「求電子試薬・求核試薬」へ展開し,電子の動きから有機反応の理解に進みます。
酸と塩基の科学史年表
イオンの発見:1833年
アレニウスの酸と塩基:1884年
電子の発見:1897年
ブレンステッド・ローリーの酸と塩基:1923年
ルイスの酸と塩基:1923年
定義4 ウサノビッチの酸と塩基の定義
現在では,適用範囲が広すぎるために使われることはありません。「1939年」にソビエト連邦のウサノビッチにより報告されました。
【ウサノビッチの酸】とは,水素イオンおよびその他の陽イオンを放出する化合物
【ウサノビッチの塩基】とは,陰イオンおよび電子と結合できる化合物
この定義に従うと,ほとんど全ての化学反応が酸塩基反応となるので使われていません。
定義α ラックスフラッドの酸と塩基の定義
溶融塩や地球科学ではチラホラ見ることがあります。「ルイスの酸と塩基」で定義できるためにあまり注目されないラックスフラッドの酸と塩基です。Hermann Luxが「1939年」に報告し,Håkon Floodが「1947年」に改良しました。
【ラックス・フラッドの酸】とは,酸化物イオン(O2–)を受け取る(アクセプター)ことができる化合物である。
【ラックス・フラッドの塩基】とは, 酸化物イオン(O2–)を与える(ドナー)ことのできる化合物である。
前述のとおり,ルイス酸で定義できるように「授受」について酸と塩基で同じ考えです。
ラックス・フラッドの酸と塩基では,化合物中に「水素イオン」を含んでいなくても適用できるので,ブレンステッドローリーの定義よりは改良されていると考えられますね。
【例】酸化金属との反応
- MgO + CO2 → MgCO3
- CaO + CO2 → CaCO3
- CaO + SiO2 → CaSiO3
上記の反応は,先にある(MgOとCaO)が「ラックスフラッドの塩基」であり,後者が「ラックスフラッドの酸」です。
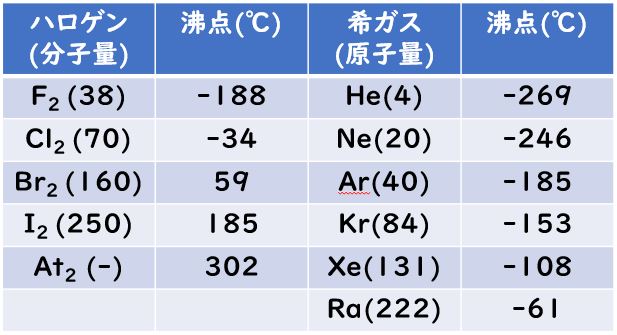
この「ラックスフラッドの酸と塩基」は、希ガス化合物、特にキセノンの酸化物、フッ化物、オキソフッ化物の反応の体系化にも有効に使われています。
最後に
科学史背景に,どのように学問が発展してきたかを学ぶことで,体系化できるかと思います。イオンより小さい電子は後に見つかります。アレニウスやブレンステッドローリーは,「イオン」で酸塩基を定義しました。その定義の問題点について,ルイスが「電子」を使いました。
定義としては,適用範囲や問題点がないように,科学は発展します。
この科学の発展を意識すると,理解も深まるかと思います。













コメントを書く