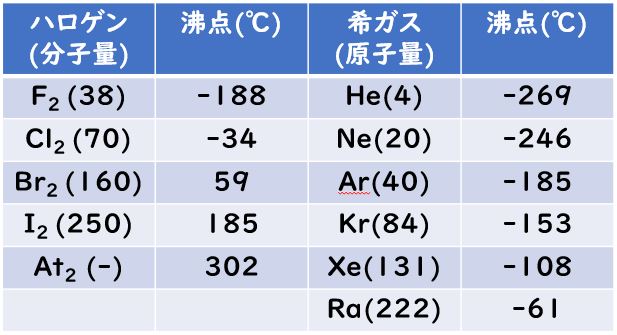
Valence Shell Electron Pair Repulsion Theoryの頭文字をとったVSEPR則。日本語では,原子価殻電子対反発則という。その名の通り,反発による立体構造の予想ができる古典的な理論です。
理論をざっくり言うと,
それぞれの結合に関与する結合電子対(共有電子対)と結合に関与しない孤立電子対(非共有電子対)を「風船」に見立てて,それらがどう密に接するかを考えています。

風船同士はなるべく遠ざかって接して集まろうとしますよね。その結果,反発の総和が最小になるように分子が形を作ります。
▼
結果,VSEPR則で予想される分子の形は「6種類」です。
VSEPR則のポイント
VSEPR則で理解すべき内容は「2点」です。
分子の立体構造
中心原子にn個の結合電子対 および m個の孤立電子対がある場合,この「n+m」を占有度と言います。
この占有度の数によって,分子の立体構造を予想できなければなりません。
中心原子を含む「結合角」
前述のとおり,結合電子対と孤立電子対を風船に見立てます。
この風船は大きさが違います。
結合電子対は,中心原子と結合している原子とで電子を共有しているため,風船の膨らみ(電子密度)は小さいです。
一方で,孤立電子対は中心原子単独で所有しているので,風船の膨らみは大きいです。
つまり,大きさの違う風船がなるべく遠ざかるように集めて持つ場合,その全体的な構造に「歪み」が生じます。そのため,「結合角に微妙なズレ」が生じます。
YouTube動画の紹介
これらの内容を解説した動画は下記です。 ブログの内容とは切り口が違う部分もあるので,理解が深まるかと思います。
占有度の違いによる分子構造の予想と角度
占有度と分子構造の関係を示すと以下の通りです。
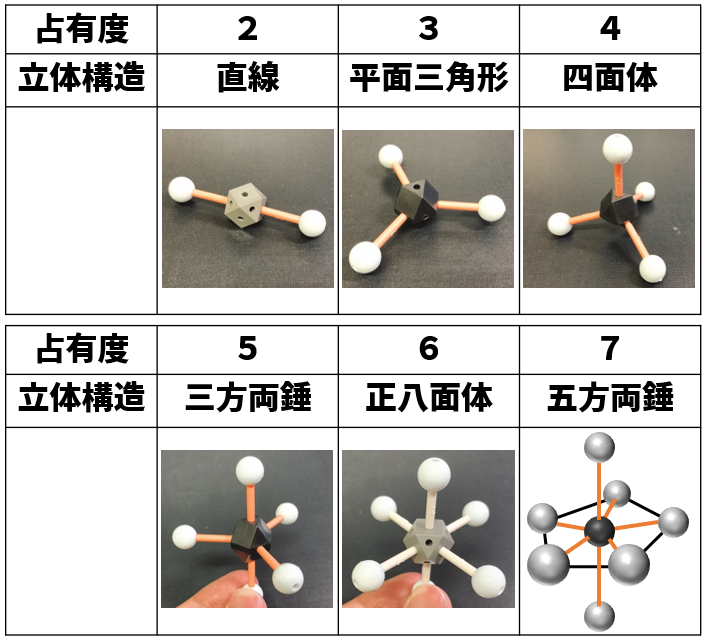
ここに載っている立体構造は,全て結合電子対の時を示しています。この一部が孤立電子対に代わることで,三方両錘も「歪三方両錘」と名称がかわります。
▼
さて,具体的に見ていきましょう。
YouTube動画で言うと,7:00頃から始まります >> 【無機化学 15 】VSEPR則による占有度2-7の立体構造と解き方 「19分で納得」
占有度2:二酸化炭素 あるいは 一酸化炭素
二酸化炭素(CO2);直線構造 180度
中心原子を炭素(C)として,両端に酸素(O)が来ます。両酸素とも二重結合で炭素と結合しています。炭素の価電子は,2s22p2です。結合に使われている電子が4個で結合電子対は2個と孤立電池対が0個ですので,占有度は2となり直線構造になることが予想されます。

中心原子を含む「結合角」は180度です。
一酸化炭素(CO);直線構造 180度
炭素と酸素は三重結合でつながっています。中心原子とみなす炭素には,ひとつの結合電子対と非共有電子対があります。
ただ,全体で2個の原子しかないので,直線構造にしかなれません。
占有度3 三フッ化ホウ素 および 二酸化硫黄
三フッ化ホウ素 (BF3);平面三角形 120度
中心原子をホウ素(B)としてフッ素原子と結合しています。ホウ素の価電子は,2s22p1です。結合電子対が3つで孤立電子対はありません。占有度は3ですので,平面三角形と予想されます。
中心のホウ素を含む結合角は,120度ですよね。

二酸化硫黄(SO2); 折れ線型 119度
中心原子である硫黄の価電子は3s23p4です。2個の酸素とそれぞれ二重結合を形成するので,結合電子対に使われる電子は4つなので2個の結合電子対ができます。つまり,n=2
価電子は6個なので,残りは2個の電子です。この電子が孤立電子対に使われます。m = 1
占有度は,3なので平面三角形となります。
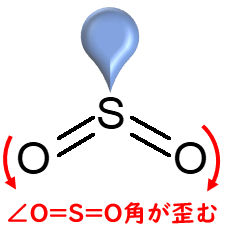
ただし,孤立電子対は見えないので,平面三角形ではなく「折れ線型」となります。
三フッ化ホウ素の場合,結合角は120度でしたが,二酸化硫黄の場合は「ゆがみます」。
上述のとおり,孤立電子対は大きいので,「赤い矢印」で示すように「O=S=O」の角度がゆがみます。結果として,120度ではなく,119度となります。
占有度4; メタン ,水 , アンモニア
結論から言うと,メタン・水・アンモニアは全て占有度が「4」となるので正四面体となります。
ただし,孤立電子対の数が異なるため,その立体構造の「名称」と結合角が変化します。
まー,私が問題作るなら「ココ」を聞きますよね。
VSEPR則の大体が詰まっているのが占有度4です。

では,具体的に見ていきましょう。
メタン(CH4);正四面体型 109.4度
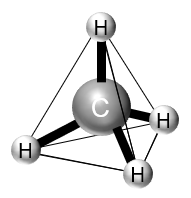
幾何学的な正四面体構造です。中心原子である炭素を含む結合角は,幾何学的に「109.4度」とわかります。
立体構造も,正四面体です。
アンモニア(NH3);三角錐型 106.7度c
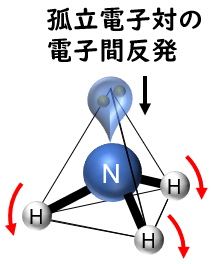
メタンと違って,孤立電子対がひとつあります。結果として,結合角は107度と小さくなります。
この後の「水」を見てもわかりますが,孤立電子対が増えると,ゆがんで結合角が「小さく」なります。
二酸化硫黄と同様に,孤立電子対は見えないので,正四面体構造ではなく,エジプトのピラミッド(pyramid)である三角錐構造となります。
※エジプトのピラミッドは四角錘です。英語の「Pyramid」は「錘」という意味があるので,三角錐は「Triangular pyramid」,四角錘は「Quadrangular pyramid」と言います。

水(H2O);折れ線型 104.5度
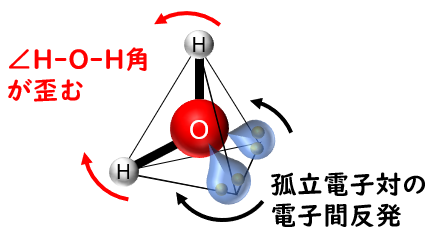
アンモニアから,さらに孤立電子対が増え,角度も狭くなります。>>104度
さらには,孤立電子対が見えないので,もはや1個の酸素原子と2個の水素原子による折れ線型となります。
他の占有度5,6,7
他の占有度については,YouTube動画をご覧ください。 >> VSEPR則による占有度2-7の立体構造と解き方
それぞれの占有度を代表する化合物名を記載します。
- 占有度5;四フッ化硫黄(SF4),三フッ化塩素(ClF3),五塩化リン(PCl5)
- 占有度6;四フッ化キセノン(XeF4),五フッ化塩素(ClF5),六フッ化硫黄(SF6)
- 占有度7;五フッ化キセノン (XeF5–),六フッ化キセノン(XeF6),七フッ化ヨウ素(IF7)
VSEPR則の限界
周期表の下に行けば行くほど原子やイオンサイズが大きくなります。
【無機化学 6 】原子半径の規則性 「9分で納得」/ Atom radius
【無機化学 9 】イオン半径とイオン化エネと電子親和力 「7分で納得」/ Ionic radius
大きな原子は小さな原子よりも立体構造をゆがめます。似たような大きさの球の中に,ひときわ大きな球が入ると,ゆがみますよね。
そのため,第3周期以降の原子を含む場合,VSERP則の立体構造と結合角に大きな逸脱が見られ始めます。
VSERP理論で登場する立体構造は,第3周期以降の元素を含むことはマレになるということです。
YouTubeラボ一覧
無機化学 >> こちら
物理化学 >> こちら
機器分析 >> こちら
Youtubeはこちらから → YouTubeチャンネル「とものらぼ」



![[YouTube動画]電子軌道と電子配置と周期表の成立ち](https://tomonolab.com/wp-content/uploads/2021/11/6034-000855-56a12ee85f9b58b7d0bcd9f8-5c759a244cedfd0001de0ad9-150x150.jpg)